
【题目】下列有关物质性质与用途具有对应关系的是
A. Al2O3熔点高,可用作耐高温材料
B. FeCl3溶液呈酸性,可用于腐蚀电路板上的Cu
C. 石墨具有导电性,可用于制铅笔芯
D. 浓硫酸具有强氧化性,可用于干燥CO2
科目:高中化学 来源: 题型:
【题目】实验室用 98%、密度为1.84g/cm3的浓硫酸配制0.2mol/L的 H2SO4溶液1000mL.
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、 、 。
(2)其操作步骤可分解为以下几步:
A.用量筒量取 mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,
并用玻璃棒搅拌。
B.用适量蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都移入容量瓶里。
C.将稀释后的硫酸小心地用玻璃棒引流容量瓶里。
D.检查容量瓶是否漏水。
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1-2cm处。
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液。
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切。
请据此填写:
①完成上述步骤中的空白处。
②补充完成正确的操作顺序(用字母填写):
( D )→( A )→( C )→( )→( )→( )→( F )。
③将浓硫酸在烧杯中稀释后移入容量瓶时,必须_________________方可移液.
(3)试分析下列操作对所配溶液的浓度有何影响
①量取浓硫酸时眼睛俯视刻度线,会导致所配溶液浓度会 ;(填:偏高、偏低、或无影响,下同)
②定容时,眼睛俯视刻度线,所配溶液浓度会 ;
③定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度。所配溶液浓度会 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于细胞中元素与分子的叙述中,正确的是
A. 微量元素不参与血红蛋白的构成
B. 组成拟核与磷脂的元素种类不同
C. DNA与三磷酸腺苷中的五碳糖不同
D. T2噬菌体的遗传信息贮存在于脱氧核苷酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过CaCl2管(A)和碱石灰(B),测得A管质量增加了2.16 g,B管增加了9.24 g,已知该有机物的相对分子质量为108。
(1)求此有机物的分子式。
(2)该有机物1分子中有1个苯环,试写出它的同分异构体的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4)是有机合成的重要还原剂。某课题组经查阅资料后设计合成铝氢化钠的简易流程如图所示。

已知:①AlCl3、NaH、NaAlH4遇水都能迅速发生反应。
②常温下,可用高锰酸钾、氯酸钾、重铬酸钾、次氯酸钙等与浓盐酸反应制取氯气。
(1)铝氢化钠遇水发生剧烈反应,甚至可能发生爆炸,其原因是_______________。写出铝氢化钠与水反应的化学方程式_____________________。
(2)甲同学设计实验制备无水氯化铝的装置如图所示。
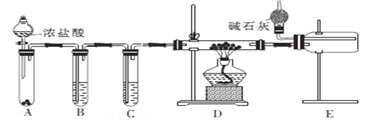
①装置E中干燥管的作用是_______________________。
②点燃装置D处酒精灯之前 需先排尽装置内的空气,其操作方法是________________。
(3)乙同学分析甲同学设计的装置后,认为只改变A、B、D中的试剂就可以用甲同学设计的装置制备NaH。
①试管B中的试剂改为____________________。
②若操作不当,则制得的NaH产品中可能含有的杂质有_________________。
(4)丙同学设计以下4种装置测定铝氢化钠样品的纯度(假设杂质不参与反应)。




从易操作性、准确性角度考虑,宜选装置________。铝氢化钠与水完全反应,冷却至室温的标志是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚醛树脂是应用广泛的高分子材料,可用酚类与醛类在酸或碱的催化下相互缩合而成,类似的合成过程如:
反应①:
反应②:
(1)化合物I的分子式____________。
(2)苯酚与浓溴水反应的化学方程式为___________________________。
(3)化合物 也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为_______________________________;有机物Ⅲ发生类似反应②的反应,生成高分子化合物IV的结构简式为_____________________。
也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为_______________________________;有机物Ⅲ发生类似反应②的反应,生成高分子化合物IV的结构简式为_____________________。
(4)有关化合物Ⅱ和Ⅲ的说法正确的有_________(填字母)。
A.都属于芳香烃
B.都能与FeCl3溶液发生显色反应
C.都能与NaHCO3溶液反应放出CO2
D.l mol的Ⅱ或Ⅲ都能与2mol的NaOH完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据乙烯和乙酸的结构与性质,推测CH2=CH—COOH能发生的反应有( )
①加成反应 ②取代反应 ③氧化反应
A.①②B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物中含有的杂质(括号内为杂质),可用稀NaOH溶液作试剂并采用分液的方法除去的是
A.苯(溴) B.淀粉(葡萄糖)
C.甲苯(苯酚) D.苯甲酸(苯酚)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在生活和生产中应用广泛。
(1)已知:900 K时,4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g),反应自发。
2Cl2(g)+2H2O(g),反应自发。
①该反应是放热还是吸热,判断并说明理由___________________________。
②900 K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。_____________________

(2)已知:Cl2(g)+2NaOH(aq)===NaCl(aq)+NaClO(aq)+H2O(l) ΔHl=-102 kJ·mol-1
3Cl2(g)+6NaOH(aq)===5NaCl(aq)+NaClO3(aq)+3H2O(l) ΔH2=-422 kJ·mol-1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式:________________________________。
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为ct mol·L-1,写出该时刻溶液中Cl-浓度的表达式:c(Cl-)=________________(用c0、ct表示)mol·L-1。
③有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO-===ClO![]() + Cl-
+ Cl-
Ⅱ.ClO![]() +ClO-===ClO
+ClO-===ClO![]() +Cl-
+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com