
| 开始沉淀 | 沉淀完全 | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |

分析 向稀硫酸和稀硝酸的混合溶液中加入粗铜,发生的离子反应方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O、Fe+NO3-+4H+=Fe3++NO↑+2H2O,将生成的NO和O2的混合气体通入混合溶液中,发生的反应为4NO+3O2+2H2O=4HNO3,能防止NO污染空气且能减少浪费;调节溶液的pH,将生成的Fe 3+转化为Fe(OH)3沉淀,然后过滤得到沉淀Fe(OH)3,向滤液中加入硫酸,然后蒸发浓缩、冷却结晶、过滤得到CuSO4•5H2O晶体;
(1)根据反应方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O、Fe+NO3-+4H+=Fe3++NO↑+2H2O中氢离子和硝酸根关系确定操作①所需的混酸溶液中硝酸和硫酸的理论配比(物质的量之比);
操作②中把生成的NO和氧气混合通入水中,它们之间发生反应能生成硝酸;
(2)Fe3+在pH=1.9时开始产生沉淀;实际操作中一般不用加水法调节溶液pH,因为加入水会导致溶液体积增大,溶液体积太大不利于蒸发浓缩;
(3)操作④中物质Y有利于生成硫酸铜晶体;
从溶液中获取晶体的措施是蒸发浓缩、冷却结晶、过滤、洗涤、干燥等;
(4)当固体质量为8.0g时,观察到固体完全呈黑色,则此时黑色固体是CuO,n(CuO)=$\frac{8.0g}{80g/mol}$=0.1mol,根据Cu原子守恒得n(CuO)=n(CuSO4•xH2O)=0.1mol,则m(CuSO4•xH2O)=n(CuSO4•xH2O).M(CuSO4•xH2O)=0.1mol×(160+18x)g/mol=25.0g,据此计算x值.
解答 解:向稀硫酸和稀硝酸的混合溶液中加入粗铜,发生的离子反应方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O、Fe+NO3-+4H+=Fe3++NO↑+2H2O,将生成的NO和O2的混合气体通入混合溶液中,发生的反应为4NO+3O2+2H2O=4HNO3,能防止NO污染空气且能减少浪费;调节溶液的pH,将生成的Fe 3+转化为Fe(OH)3沉淀,然后过滤得到沉淀Fe(OH)3,向滤液中加入硫酸,然后蒸发浓缩、冷却结晶、过滤得到CuSO4•5H2O晶体;
(1)根据反应方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O、Fe+NO3-+4H+=Fe3++NO↑+2H2O中氢离子和硝酸根物质的量之比为4:1,一个硝酸分子提供一个H+、每个硫酸分子提供2个H+,要使混合溶液中n(H+):n(NO3-)=4:1,则与操作①所需的混酸溶液中硝酸和硫酸的理论配比(物质的量之比)2:3;
操作②中把生成的NO和氧气混合通入水中,它们之间发生反应能生成硝酸,所以加入物质是O2,发生的反应为2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3,
故答案为:2:3;O2;2NO+O2=2NO2、4NO2+O2+2H2O=4HNO3;
(2)根据表中数据知,Fe3+在pH=1.9时开始产生沉淀;实际操作中一般不用加水法调节溶液pH,因为加入水会导致溶液体积增大,溶液体积太大不利于蒸发浓缩,故答案为:=;不利于蒸发浓缩;
(3)硫酸铜是强酸弱碱盐,加热时铜离子水解,为抑制水解,可以向滤液中加入稀硫酸,所以操作④中物质Y是稀硫酸;
从溶液中获取晶体的措施是蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,
故答案为:稀硫酸;冷却结晶;
(4)当固体质量为8.0g时,观察到固体完全呈黑色,则此时黑色固体是CuO,n(CuO)=$\frac{8.0g}{80g/mol}$=0.1mol,根据Cu原子守恒得n(CuO)=n(CuSO4•xH2O)=0.1mol,
则m(CuSO4•xH2O)=n(CuSO4•xH2O).M(CuSO4•xH2O)=0.1mol×(160+18x)g/mol=25.0g,x=$\frac{\frac{25.0g}{0.1mol}-160g/mol}{18g/mol}$=5,
答:n(CuO)=$\frac{8.0g}{80g/mol}$=0.1mol,根据Cu原子守恒得n(CuO)=n(CuSO4•xH2O)=0.1mol,则m(CuSO4•xH2O)=n(CuSO4•xH2O).M(CuSO4•xH2O)=0.1mol×(160+18x)g/mol=25.0g,x=$\frac{\frac{25.0g}{0.1mol}-160g/mol}{18g/mol}$=5.
点评 本题考查物质制备,为高频考点,侧重考查学生对物质性质、基本操作方法、除杂等知识点的掌握,明确流程图中发生的反应及基本操作是解本题关键,同时考查学生知识灵活运用能力,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中通入少量CO2:OH-+CO2═HCO3- | |
| B. | 用氨水吸收少量SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| C. | Al(NO3)2溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| D. | 向Fe2(SO4)3的酸性溶液中通入足量H2S:Fe3++H2S═Fe2++S↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | Fe2++Br2═Fe3++Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,对二氧化硫的排放有了大大的改善.已知SO2可以用Fe( NO3)3溶液吸收,0.1mol/L的Fe(NO3)3溶液的pH=2某学习小组据此展开如下相关探究:
安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,对二氧化硫的排放有了大大的改善.已知SO2可以用Fe( NO3)3溶液吸收,0.1mol/L的Fe(NO3)3溶液的pH=2某学习小组据此展开如下相关探究:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +H2O2
+H2O2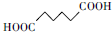 +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com