
现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度.(可供选用的反应物只有CaCO3固体、6mol/L盐酸、6mol/L硫酸和蒸馏水)
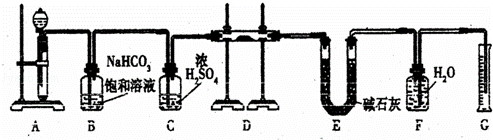
回答下列问题:
(1)装置A中液体试剂选用 ,理由是 .
(2)装置B的作用是 .装置C的作用是 .装置E中碱石灰的作用是 .
(3)装置D中发生反应的化学方程式是 .
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度 .
考点: 钠的重要化合物;探究物质的组成或测量物质的含量.
专题: 实验探究和数据处理题;几种重要的金属及其化合物.
分析: (1)根据实验原理装置A采用的是碳酸钙和盐酸反应生成二氧化碳,根据碳酸钙和硫酸反应的情况来回答;
(2)获得的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,碱石灰可以吸收二氧化碳;
(3)根据氧化钠和过氧化钠的性质来回答;
(4)根据氧气的量和过氧化钠量的关系来获得过氧化钠质量,进而计算过氧化钠的纯度.
解答: 解:(1)装置A是碳酸钙和盐酸反应生成二氧化碳,碳酸钙和硫酸反应时,生成的硫酸钙是微溶于水的,会覆盖在碳酸钙的表面,使反应不能持续,所以用盐酸而不用硫酸来反应,
故答案为:6mol/L盐酸,硫酸和碳酸钙反应生成的硫酸钙是微溶于水的,会覆盖在碳酸钙的表面,使反应不能持续;
(2)碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,可以将二氧化碳干燥,装置E中碱石灰的作用是吸收二氧化碳,防止对氧气的体积测量造成干扰,
故答案为:除去气体中的HCl;干燥气体;吸收装置D中反应剩余的二氧化碳;
(3)氧化钠和过氧化钠和二氧化碳反应的原理方程式分别为:2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3,
故答案为:2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3;
(4)根据反应2Na2O2+2CO2=2Na2CO3+O2,反应结束后测得气体体积为224mL(标准状况),即生成的氧气的量0.01mol,过氧化钠的物质的量为0.02mol,
过氧化钠的纯度=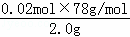 ×100%=78%,故答案为:78%.
×100%=78%,故答案为:78%.
点评: 本题考查学生过氧化钠的化学性质知识,通过实验方式考查增加了难度,综合性较强.


科目:高中化学 来源: 题型:
质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为()
A. 大于2c mol/L B. 等于2c mol/L
C. 小于2c mol/L D. 在c mol/L∽2c mol/L之间
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是()
A. 0.1 mol.L﹣1 NaOH溶液:K+、Na+、SO42﹣、CO32﹣
B. 0.1 mol•L﹣1 Na2CO3溶液:K+、Ba2+、NO3﹣、Cl﹣
C. 0.1 mol•L﹣1 FeCl3溶液:K+、NH4+、I﹣、SCN﹣
D. 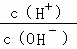 =1×l014的溶液:Ca2+、Na+、ClO﹣、NO3﹣
=1×l014的溶液:Ca2+、Na+、ClO﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是()
A. 将Na2O2投入NH4Cl溶液中只可能生成一种气体
B. 铁分别与稀盐酸和硫反应,产物中铁元素的化合价相同
C. 向饱和ZnS溶液中加入Na2S有沉淀析出,但Ksp(ZnS)不变
D. 在滴有酚酞的Na2CO3溶液中,加入适量BaCl2溶液后溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是()
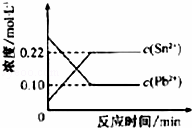
A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C. 升高温度,平衡体系中c(Pb2+)增大,说明该反应为吸热反应
D. 25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
强酸和强碱在稀溶液里反应的热化学方程式可表示为:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1已知:CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=﹣Q1 kJ•mol﹣1 HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=﹣Q2 kJ•mol﹣1上述均是在溶液中进行的反应,Q1、Q2的关系正确的是()
A. Q1=Q2=57.3 B. Q1>Q2>57.3 C. Q1<Q2=57.3 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
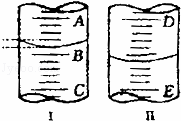
(如图)(1)图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为5,量筒中液体体积是 mL.
(2)图Ⅱ表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) .
A.是a mL B.是(25﹣a)mLC.一定大于a mL D.一定大于(25﹣a)mL
(3)已知N2(g)+2O2(g)═2NO2(g);△H=+67.7KJ/mol,
N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=﹣534KJ/mol,
则肼与NO2完全反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
欲配制100mL 1.0mol•L﹣1Na2SO4溶液,正确的方法是()
①将14.2g Na2SO4溶于100mL水中
②将32.2gNa2SO4•10H2O溶于少量水 中,再用水稀释至100mL
③将20mL 5.0mol•L﹣1Na2SO4溶液用水稀释至100mL.
A. ①② B. ②③ C. ①③ D. ①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com