
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%
【答案】D
【解析】
A. 甲容器中平衡时,消耗的CO的物质的量为1.2mol-0.8mol=0.4mol,根据反应CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol,可知平衡时放出热量为:41 kJ/mol×0.4mol=16.4 kJ,故A正确;
CO2(g) + H2(g) H = -41 kJ/mol,可知平衡时放出热量为:41 kJ/mol×0.4mol=16.4 kJ,故A正确;
B. CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
起始(mol) 1.2 0.6 0 0
转化(mol) 0.4 0.4 0.4 0.4
平衡(mol) 0.8 0.2 0.4 0.4
在T1达到平衡状态时甲容器中,c(CO)=0.4mol/L,c(H2O)=0.1mol/L,c(CO2)=0.2mol/L,c(H2)= 0.2mol/L,则该温度下反应的平衡常数K甲 = 0.2×0.2/0.4×0.1=1,故B正确;
C. CO(g) + H2O(g) ![]() CO2(g) + H2(g)为气体体积不变的反应,压强不影响化学平衡,则甲、乙互为等效平衡,达到平衡时反应物转化率相等,则0.8/1.2=a/2.4,解得a=1.6,故C正确;
CO2(g) + H2(g)为气体体积不变的反应,压强不影响化学平衡,则甲、乙互为等效平衡,达到平衡时反应物转化率相等,则0.8/1.2=a/2.4,解得a=1.6,故C正确;
D.根据C项可知a=1.6,乙容器中,平衡时CO的转化率为![]() ×100%≈33%,故D错误;
×100%≈33%,故D错误;
故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如下图,下列关于该物质的说法正确的是( )
![]()
A. 其分子式为C15H18O4
B. 1 mol该物质完全燃烧,消耗20 mol氧气
C. 既能发生加聚反应,又能发生缩聚反应
D. 既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种物质:①NO2②Al(OH)3③FeCl2④SiO2
(1)与水反应产生无色气体的是___(填序号,下同),反应的化学方程式为___。
(2)光导纤维的主要成分是___。
(3)既能与酸反应又能与强碱溶液反应的两性氢氧化物是___,该物质与强碱反应的离子方程式为___。
(4)有人预测①与③的溶液能发生化学反应,可能出现的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为制取乙酸乙酯,在试管a中加入3ml乙醇,然后边振荡试管边慢慢加入2ml浓硫酸和2ml乙酸,按下图所示连接好装置进行实验。请回答:
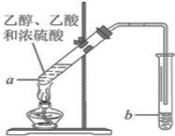
(1)试管b中盛放的溶液是_________________;
(2)实验完成后,试管b的页面上有透明的不溶于水的油状液体产生。若分离该液体混合物需要用到的玻璃仪器是______;
(3)乙醇和乙酸反应生成乙酸乙酯的反应类型是___________;
(4)在制取乙酸乙酯中,有关浓硫酸的作用说法错误的是_______________;
A.催化剂 B.吸水剂 C.脱水剂 D.提高反应速率
(5)试管b中溶液的作用是_______________;
(6)乙酸在酯化反应中断键方式是在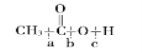 的__________处。
的__________处。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g) ![]() CH3OH(g) 反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g) 反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
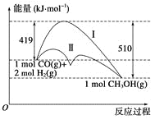
A.生成1mol CH3OH(g)时,该反应吸收的热量为91 kJ。
B.加入催化剂可以减少反应最终放出的热量
C.1mol CO(g)与2molH2(g)的总能量大于1mol CH3OH(g)的总能量
D.如果该反应生成CH3OH (l),则放出的能量会减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为____________,若将负极材料改为CH4,写出其负极反应方程式___________。
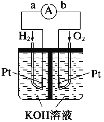
(2)NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2 mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为__________;每消耗3.4g NH3转移的电子数目为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一,其单质及化合物具有广泛的用途。
(1)基态铜原子核外有________对自旋相反的电子。
(2)青铜是铜与锡或铅等元素按一定比例熔铸而成的合金。第一电离能I1(Sn)____________I1(Pb)(填“大于”或“小于”)。
(3)新制的Cu(OH)2能够溶解于浓氨水中,反应的离子方程式是____________________________________;
(4)利用铜片表面催化反应,我国研究人员用六炔基苯为原料,在世界上首次通过化学方法获得全碳材料—石墨炔薄膜(结构片段如图所示),开辟了人工化学合成碳同素异形体的先例。石墨炔中碳原子_________________________的杂化方式。

(5)CuCl的盐酸溶液能吸收CO形成氯化羰基亚铜(I),可用于定量测定气体混合物中CO的含量。氯化羰基亚铜(I)中含___________σ键数目。
(6)Cu2O可用于半导体材料。
①Cu2O晶胞(如图所示)中,O原子的配位数为________________;a位置Cu+坐标为(0.25,0.25,0.75),则b位置Cu+坐标_______________________。
②Cu2S与Cu2O具有相似晶体结构,则两者的熔点是Cu2O比Cu2S的_________(填“高”或“低”),请解释原因___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.20 mol/LKMnO4酸性溶液 0.l0L与一定量pH=3.0的草酸(HOOC-COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是
A.9 g HOOC-COOH含共用电子对数目为0.9NA
B.当0.01mol KMnO4 被还原时,强酸提供的H+数目为 0.01NA
C.pH=3.0的草酸溶液含有H+数目为0.001NA
D.该反应释放 CO2分子数目为VNA/22.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胡椒粉是植物挥发油的成分之一。它的结构简式为![]() ,下列叙述中不正确的是( )
,下列叙述中不正确的是( )
A. 该有机物分子式为C9H10O
B. 1mol胡椒粉最多可与1mol溴水发生反应
C. 1mol胡椒粉最多可与4mol氢气发生反应
D. 胡椒粉可与FeCl3 溶液显紫色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com