
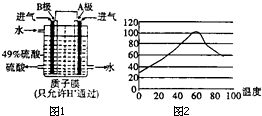
 我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品.
我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品. ①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;
①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;分析 (1)二硫化亚铁与氧气反应生成三氧化二铁和二氧化硫;增大接触面积可以加快反应速率;
(2)①判断化学平衡状态可以依据平衡状态的本质:V正=V逆;
可以根据平衡状态的特征:定,反应未达到平衡状态时,始终变化的量不变;
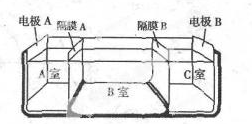
②石墨电极多空溶于具有吸附性,能吸收气体;B电极生成硫酸,所以B通入的是二氧化硫,二氧化硫在B电极上发生氧化反应失去电子生成硫酸根离子;
(3)①根据烧渣成分判断生成物,依据氧化还原反应得失电子守恒、原子个数守恒写出方程式;
②根据溶解度曲线可知60℃溶解度最大,所以此温度下能够得到浓度最大的溶液;
由溶液获得晶体的一般操作:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
③依据滴定实验的反应终点时发生的反应进行计算,依据铁元素守恒,结合滴定过程的反应离子方程式计算得到;
解答 解:(1)二硫化亚铁与氧气反应生成三氧化二铁和二氧化硫,化学方程式为:3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
煅烧时黄铁矿要粉碎是为了增大反应物接触面积,加快反应速率;
故答案为:3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;使黄铁矿能够迅速而充分燃烧;
(2)①A.v(SO2)、v(SO3)表示同一方向速率,不能表示V正=V逆,故A错误;
B.该反应2SO2+O2$?_{△}^{催化剂}$2SO3,为气体系数前后不等的反应,依据M=$\frac{m}{n}$,可知m为定制,n未达到平衡时为变量,所以当混合物的平均相对分子质量不变,可以判断达到平衡状态,故B正确;
C.该反应2SO2+O2$?_{△}^{催化剂}$2SO3,为气体系数前后不等的反应,混合气体体积是个变量,当混合气体的体积不变时可以说明达到平衡状态,故C正确;
D.各组分的体积分数不变,未达到平衡时为变量,当各组分的体积分数不变说明反应达到平衡状态,故D正确;
故选:BCD;
②电极多空溶于具有吸附性,能吸收气体;B电极生成硫酸,所以B通入的是二氧化硫,二氧化硫在B电极上发生氧化反应失去电子生成硫酸根离子,电极反应式为:SO2+2H2O-2e-=SO42-+4H+;
故答案为:能吸附气体,使气体与电解质溶液充分接触;SO2+2H2O-2e-=SO42-+4H+;
(3)①从转化关系可知:硫化氢与硫酸铁发生氧化还原反应生成硫、硫酸亚铁和硫酸,化学方程式:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;
故答案为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;
②根据溶解度曲线可知60℃溶解度最大,所以此温度下能够得到浓度最大的溶液;
由溶液获得晶体的一般操作:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
故答案为:60℃;蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
③25mL待测液消耗的高锰酸钾的物质的量为:0.01mol/L×0.04L=0.0004mol,
5.7g产品配成250mL溶液消耗高锰酸钾的物质的量为0.0004mol×$\frac{250}{25}$=0.004mol,
根据反应方程式:
5Fe2++1MnO4-+8H+═5Fe3++Mn2++4H2O,
5 1
n(Fe2+)0.004mol;
解得n(Fe2+)0.004mol×5=0.02mol;
所以样品中含有的FeSO4•7H2O的质量为:278g/mol×0.02mol=5.56g,
FeSO4•7H2O的质量分数为:$\frac{5.56g}{5.7g}$×100%≈97.5%,
故答案为:0.975或97.5%.
点评 本题所以黄铜矿为载体考查化学方程式的书写,平衡状态的判断,有关方程式的计算,题目难度中等,注意对学知识的灵活运用.


科目:高中化学 来源: 题型:解答题
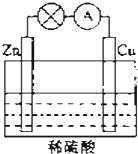 电能是现代社会应用最广泛的能源之一.如图所示的原电池装置中,其负极是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑.原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.
电能是现代社会应用最广泛的能源之一.如图所示的原电池装置中,其负极是Zn,正极上能够观察到的现象是铜片表面产生无色气泡,正极的电极反应式是2H++2e-=H2↑.原电池工作一段时间后,若消耗锌6.5g,则放出气体0.2g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH一的数目为0.2NA | |
| B. | 取50mL 14.0moI.L-l浓硝酸与足量的铜片反应,生成气体分子的数目为0.35NA | |
| C. | 标准状况下,2.24L二氧化硫中含有的电子总数为3.2NA | |
| D. | 28gN2与28g C18O中含有的质子数均为14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用元素分析仪确定有机化合物的组成时具有所需样品量小,分析速度快的优点 | |
| B. | 钠融法可以定性确定有机物中是否含有C、H、O等元素 | |
| C. | 测定有机化合物组成元素的方法还有核磁共振、红外光谱等方法 | |
| D. | 甲醚和乙醇是同分异构体,它们在核磁共振谱中出现的特征峰分别是1个和2个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验装置 | 实验目的 |
| A | 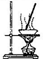 | 加热硫酸铜晶体获得无水硫酸铜 |
| B | 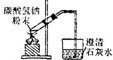 | 加热碳酸氢钠,证明它能分解释放出二氧化碳气体 |
| C |  | 实验室制取氯气 |
| D | 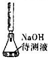 | 用中和滴定的方法测定某氢氧化钠待测液的浓度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| B. | 向硝酸银溶液中加入足量的氨水:Ag++2NH3•H2O═Ag(NH3)2++2H2O | |
| C. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H20═2Al(OH)3↓+3CO2↑ | |
| D. | 用足量的氨水处理硫酸工业的尾气:SO2+NH3•H2O═NH4++HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 双氧水是一种对环境友好的消毒剂、漂白剂,广泛应用于化工、医药、环保等领域.请回答下列问题:
双氧水是一种对环境友好的消毒剂、漂白剂,广泛应用于化工、医药、环保等领域.请回答下列问题: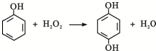 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com