
分析 根据N=nNA计算出含有的硫酸分子数目;硫酸分子中含有2个H、1个S、4个O原子,据此计算出含有H、O、S的物质的量;硫酸分子中含有50个电子,据此计算出1.5mol硫酸分子中含有的电子的物质的量.
解答 解:1.5mol H2SO4中含1.5NA个H2SO4分子,含有H原子的物质的量为:1.5mol×2=3mol,含有S原子的物质的量为1.5mol,含有O的物质的量为:1.5mol×4=6mol;
含有电子的物质的量为:1.5mol×50=75mol,
故答案为:1.5NA;3;1.5;6;75.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 向水中加入KHSO4溶液 | B. | 将水加热到100℃,使pH=6 | ||
| C. | 向水中加入Na3PO4溶液 | D. | 向水中加入ZnSO4固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D2+>B2+>A2+>C2+ | B. | A2+>B2+>C2+>D2+ | C. | C2+>A2+>B2+>D2+ | D. | A2+>C2+>D2+>B2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2具有强的氧化性,可以做供氧剂 | |
| B. | Na2CO3溶液呈碱性,可以清除餐具表面的油污 | |
| C. | 晶体硅熔点高、硬度大,可用于制作半导体材料 | |
| D. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
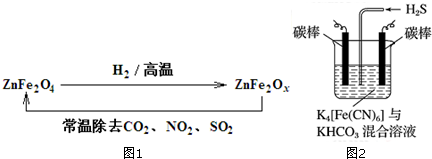
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com