
| Fe2O3 | CO | Fe | CO2 | |
| ¼×/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ŅŅ/mol | 1.0 | 2.0 | 1.0 | 1.0 |
·ÖĪö £Ø1£©¢ŁFe2O3£Øs£©+3C£ØŹÆÄ«£©=2Fe£Øs+3CO£Øg£©”÷H1=+489.0kJ•mol-1
¢ŚC£ØŹÆÄ«£©+CO2£Øg£©=2CO£Øg£©”÷H2=+172.5kJ•mol-1£»¢Ł-¢Ś”Į3µĆµ½Fe2O3£Øs£©+3CO£Øg£©=2Fe£Øs£©+3CO2£Øg£©£¬ŅŌ“Ė¼ĘĖć·“Ó¦µÄģŹ±ä
£Ø2£©KĪŖÉś³ÉĪļÅضČĆŻÖ®»żÓė·“Ó¦ĪļÅضČĆŻÖ®»żµÄ±Č£¬¹ĢĢå²»ÄÜ“śČėKµÄ±ķ“ļŹ½ÖŠ£»øĆ·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶Č£¬»ÆŃ§Ę½ŗāÄęĻņŅĘ¶Æ£»
£Ø3£©¢ŁŌŚT”ꏱ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżK=64£¬¼×ČŻĘ÷ÄŚÅضČÉĢQc=1£¬Š”ÓŚĘ½ŗā³£Źż£¬·“Ó¦ĻņÕż·“Ó¦½ųŠŠ£¬ÉčĻūŗÄŅ»Ńõ»ÆĢ¼ĪļÖŹµÄĮæĪŖx£¬Ōņ£ŗ
Fe2O3£Øs£©+3CO£Øg£©?2Fe£Øs£©+3CO2£Øg£©
ĘšŹ¼Įæ£Ømol£©£ŗ1 1
±ä»ÆĮæ£Ømol£©£ŗx x
Ę½ŗāĮæ£Ømol£©£ŗ1-x 1+x
¹Ź$\frac{£Ø1+x£©^{3}}{£Ø1-x£©^{3}}$=64£¬½āµĆx=0.6£¬
ŅŌ“Ė¼ĘĖćCOµÄ×Ŗ»ÆĀŹ£»
¢Śa£®·“Ó¦Ē°ŗóĘųĢåÖŹĮæ±ä»Æ£¬Ģå»ż²»±ä£¬ĆܶČĪŖ±äĮ棻
b£®Fe2O3ĪŖ¹ĢĢåĮ棬Ōö¼ÓĘäÓĆĮ棬²»Ó°Ļģ»ÆŃ§Ę½ŗāŅĘ¶Æ£»
c£®ŅŅĻąµ±ÓŚŌŚ¼×Ę½ŗāµÄ»ł“”ÉĻ¼ÓČė1molCO£¬·“Ó¦ĖŁĀŹ¼Óæģ£»
d£®ŅŅČŻĘ÷ÄŚÅضČÉĢQc=0.125£¬Š”ÓŚĘ½ŗā³£Źż£¬·“Ó¦ĻņÕż·“Ó¦½ųŠŠ£¬ĮīĘ½ŗāŹ±ŅŅÖŠ²Ī¼Ó·“Ó¦µÄCOĪŖymol£¬Ōņ£ŗ
Fe2O3£Øs£©+3CO£Øg£©?2Fe£Øs£©+3CO2£Øg£©
ĘšŹ¼Įæ£Ømol£©£ŗ2 1
±ä»ÆĮæ£Ømol£©£ŗy y
Ę½ŗāĮæ£Ømol£©£ŗ2-y 1+y
·“Ó¦Ē°ŗóĘųĢåĢå»ż²»±ä£¬æÉŅŌÓĆĪļÖŹµÄĮæ“śĢęÅØ¶Č¼ĘĖćĘ½ŗā³£Źż£¬¹Ź$\frac{£Ø1+y£©^{3}}{£Ø2-y£©^{3}}$=64£¬½āµĆy=1.4£¬¹ŹĘ½ŗāŹ±ŅŅČŻĘ÷ÄŚCOĪŖ2mol-1.4mol=0.6mol£¬ÓÉ¢ŁÖŠµÄ¼ĘĖćæÉÖŖĘ½ŗāŹ±£¬¼×ÖŠCOĪŖ1mol-0.6mol=0.4mol£¬£»
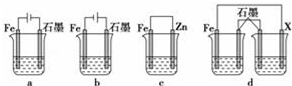
£Ø4£©¢Ła×°ÖĆÖŠĢśĮ¬½ÓµēŌ“µÄÕż¼«£¬ĪŖŃō¼«£¬·¢ÉśŃõ»Æ·“Ó¦£»
b×°ÖĆÖŠĢśĮ¬½ÓµēŌ“µÄøŗ¼«£¬ĪŖŅõ¼«£¬Äܱ£»¤Ģś²»±»øÆŹ“£»
c×°ÖĆÖŠ£¬Šæ±ČĢś»īĘĆ£¬Šæ×÷øŗ¼«£¬Ģś±»±£»¤£»
¢ŚČōd×°ÖĆÄܹ»±£»¤Ģś£¬ŌņXµÄ»īĘĆŠŌÓ¦±ČĢś»īĘĆ£¬Ź¹ÓŅ²ą×°ÖĆĪŖŌµē³Ų£¬×ó²ą×°ÖĆĪŖµē½ā³Ų£¬¹¹³ÉĶā½ÓµēŌ“µÄŅõ¼«±£»¤·Ø£¬XæÉŅŌŹĒZn”¢AlµČ»īĘĆµÄ½šŹō£»
£Ø5£©øł¾ŻĒāŃõ»ÆĆ¾ŗĶĒāŃõ»ÆĢśµÄČܽāĘ½ŗāŅŌ¼°ČܶȻż±ķ“ļŹ½£¬Ōņµ±Į½ÖÖ³Įµķ¹²“ęĒŅČÜŅŗµÄpH=8Ź±£¬½įŗĻKsp¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©¢ŁFe2O3£Øs£©+3C£ØŹÆÄ«£©=2Fe£Øs+3CO£Øg£©”÷H1=+489.0kJ•mol-1
¢ŚC£ØŹÆÄ«£©+CO2£Øg£©=2CO£Øg£©”÷H2=+172.5kJ•mol-1£»¢Ł-¢Ś”Į3µĆµ½Fe2O3£Øs£©+3CO£Øg£©=2Fe£Øs£©+3CO2£Øg£©£¬øł¾ŻøĒĖ¹¶ØĀɵƵ½·“Ó¦µÄģŹ±ä”÷H=+489.0kJ•mol-1-3”Į£Ø+172.5kJ•mol-1£©=-28.5kJ•mol-1£®
¼“a=-28.5£¬
¹Ź“š°øĪŖ£ŗ-28.5£»
£Ø2£©Fe2O3£Øs£©+3CO£Øg£©$\frac{\underline{\;øßĪĀ\;}}{\;}$2Fe£Øs£©+3CO2£Øg£©µÄĘ½ŗā³£ŹżK=$\frac{{c}^{3}£ØC{O}_{2}£©}{{c}^{3}£ØCO£©}$£¬øĆ·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶Č£¬»ÆŃ§Ę½ŗāÄęĻņŅĘ¶Æ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżKÖµ½«¼õŠ”£¬
¹Ź“š°øĪŖ£ŗ$\frac{{c}^{3}£ØC{O}_{2}£©}{{c}^{3}£ØCO£©}$£»¼õŠ”£»
£Ø3£©¢ŁŌŚT”ꏱ£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżK=64£¬¼×ČŻĘ÷ÄŚÅضČÉĢQc=1£¬Š”ÓŚĘ½ŗā³£Źż£¬·“Ó¦ĻņÕż·“Ó¦½ųŠŠ£¬ÉčĻūŗÄŅ»Ńõ»ÆĢ¼ĪļÖŹµÄĮæĪŖx£¬Ōņ£ŗ
Fe2O3£Øs£©+3CO£Øg£©?2Fe£Øs£©+3CO2£Øg£©
ĘšŹ¼Įæ£Ømol£©£ŗ1 1
±ä»ÆĮæ£Ømol£©£ŗx x
Ę½ŗāĮæ£Ømol£©£ŗ1-x 1+x
·“Ó¦Ē°ŗóĘųĢåĢå»ż²»±ä£¬æÉŅŌÓĆĪļÖŹµÄĮæ“śĢęÅØ¶Č¼ĘĖćĘ½ŗā³£Źż£¬¹Ź$\frac{£Ø1+x£©^{3}}{£Ø1-x£©^{3}}$=64£¬½āµĆx=0.6£¬
¹ŹCOµÄ×Ŗ»ÆĀŹ=$\frac{0.6mol}{1mol}$”Į100%=60%
¹Ź“š°øĪŖ£ŗ60%£»
¢Śa£®·“Ó¦Ē°ŗóĘųĢåÖŹĮæ±ä»Æ£¬Ģå»ż²»±ä£¬ČōČŻĘ÷ÄŚĘųĢåĆܶČŗć¶ØŹ±£¬±źÖ¾·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬¹ŹaÕżČ·£»
b£®Fe2O3ĪŖ¹ĢĢåĮ棬Ōö¼ÓĘäÓĆĮ棬²»Ó°Ļģ»ÆŃ§Ę½ŗāŅĘ¶Æ£¬²»ÄÜĢįøßCOµÄ×Ŗ»ÆĀŹ£¬¹Źb“ķĪó£»
c£®ŅŅĻąµ±ÓŚŌŚ¼×Ę½ŗāµÄ»ł“”ÉĻ¼ÓČė1molCO£¬·“Ó¦ĖŁĀŹ¼Óæģ£¬¹ŹŅŅČŻĘ÷ÖŠCOĘ½ŗāŹ±µÄĖŁĀŹøüøߣ¬¹Źc“ķĪó£»
d£®ŅŅČŻĘ÷ÄŚÅضČÉĢQc=0.125£¬Š”ÓŚĘ½ŗā³£Źż£¬·“Ó¦ĻņÕż·“Ó¦½ųŠŠ£¬ĮīĘ½ŗāŹ±ŅŅÖŠ²Ī¼Ó·“Ó¦µÄCOĪŖymol£¬Ōņ£ŗ
Fe2O3£Øs£©+3CO£Øg£©?2Fe£Øs£©+3CO2£Øg£©
ĘšŹ¼Įæ£Ømol£©£ŗ2 1
±ä»ÆĮæ£Ømol£©£ŗy y
Ę½ŗāĮæ£Ømol£©£ŗ2-y 1+y
·“Ó¦Ē°ŗóĘųĢåĢå»ż²»±ä£¬æÉŅŌÓĆĪļÖŹµÄĮæ“śĢęÅØ¶Č¼ĘĖćĘ½ŗā³£Źż£¬¹Ź$\frac{£Ø1+y£©^{3}}{£Ø2-y£©^{3}}$=64£¬½āµĆy=1.4£¬¹ŹĘ½ŗāŹ±ŅŅČŻĘ÷ÄŚCOĪŖ2mol-1.4mol=0.6mol£¬ÓÉ¢ŁÖŠµÄ¼ĘĖćæÉÖŖĘ½ŗāŹ±£¬¼×ÖŠCOĪŖ1mol-0.6mol=0.4mol£¬¹Ź¼×”¢ŅŅČŻĘ÷ÖŠCOµÄĘ½ŗāÅضČÖ®±ČĪŖ0.4mol£ŗ0.6mol=2£ŗ3£¬¹ŹdÕżČ·£»
¹Ź“š°øĪŖ£ŗad£»
£Ø4£©¢Ła×°ÖĆÖŠĢśĮ¬½ÓµēŌ“µÄÕż¼«£¬ĪŖŃō¼«£¬·¢ÉśŃõ»Æ·“Ó¦£¬¼ÓĖŁĘäøÆŹ“£¬a“ķĪó£»b×°ÖĆÖŠĢśĮ¬½ÓµēŌ“µÄøŗ¼«£¬ĪŖŅõ¼«£¬Äܱ£»¤Ģś²»±»øÆŹ“£¬ŹĒĶā½ÓµēŌ“µÄŅõ¼«±£»¤·Ø£¬bÕżČ·£»c×°ÖĆÖŠ£¬Šæ±ČĢś»īĘĆ£¬Šæ×÷øŗ¼«£¬Ģś±»±£»¤£¬ŹĒĪžÉüŃō¼«µÄŅõ¼«±£»¤·Ø£¬cÕżČ·£¬
¹Ź“š°øĪŖ£ŗbc£»
¢ŚČōd×°ÖĆÄܹ»±£»¤Ģś£¬ŌņXµÄ»īĘĆŠŌÓ¦±ČĢś»īĘĆ£¬Ź¹ÓŅ²ą×°ÖĆĪŖŌµē³Ų£¬×ó²ą×°ÖĆĪŖµē½ā³Ų£¬¹¹³ÉĶā½ÓµēŌ“µÄŅõ¼«±£»¤·Ø£¬XæÉŅŌŹĒZn”¢AlµČ»īĘĆµÄ½šŹō£¬
¹Ź“š°øĪŖ£ŗŠæ£»
£Ø5£©øł¾ŻĒāŃõ»ÆĆ¾ŗĶĒāŃõ»ÆĢśµÄČܽāĘ½ŗāŅŌ¼°ČܶȻż±ķ“ļŹ½£¬Ōņµ±Į½ÖÖ³Įµķ¹²“ęĒŅČÜŅŗµÄpH=8Ź±£¬
c£ØMg2+£©=$\frac{Ksp}{c£ØO{H}^{-}£©^{2}}$=$\frac{5.61”Į1{0}^{-12}}{1{0}^{-12}}$ØT5.61mol/L£¬
c£ØFe3+£©=$\frac{Ksp}{c£ØO{H}^{-}£©^{3}}$=$\frac{2.64”Į1{0}^{-39}}{1{0}^{-18}}$=2.64”Į10-21mol/L£¬
ĖłŅŌ c£ØMg2+£©£ŗc£ØFe3+£©=5.61£ŗ2£ŗ64”Į10-21=2.215”Į1021£¬
¹Ź“š°øĪŖ£ŗ2.215”Į1021£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāµÄ¼ĘĖć£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕKµÄŅāŅ唢»ÆŃ§Ę½ŗāŅĘ¶Æ”¢Ksp¼ĘĖćµČĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄ漲飬עŅāĘ½ŗā³£Źż±ķ“ļŹ½ÖŠ²»ÄܳöĻÖ¹ĢĢ壬×ŪŗĻŠŌ½ĻĒ棬ĢāÄæÄŃ¶Č²»“ó£®


 ĘŚÄ©±¦µäµ„ŌŖ¼ģ²ā·ÖĄąø“Ļ°¾ķĻµĮŠ“š°ø
ĘŚÄ©±¦µäµ„ŌŖ¼ģ²ā·ÖĄąø“Ļ°¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
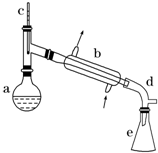 “¼ĶŃĖ®ŹĒŗĻ³ÉĻ©ĢžµÄ³£ÓĆ·½·Ø£¬ŹµŃéŹŅŗĻ³É»·¼ŗĻ©µÄ·“Ó¦ŗĶŹµŃé×°ÖĆČēĻĀ£ŗ
“¼ĶŃĖ®ŹĒŗĻ³ÉĻ©ĢžµÄ³£ÓĆ·½·Ø£¬ŹµŃéŹŅŗĻ³É»·¼ŗĻ©µÄ·“Ó¦ŗĶŹµŃé×°ÖĆČēĻĀ£ŗ $”ś_{”÷}^{ÅØĮņĖį}$
$”ś_{”÷}^{ÅØĮņĖį}$ +H2O
+H2O| Ļą¶Ō·Ö×ÓÖŹĮæ | ĆܶČ/£Øg•cm-3£© | ·Šµć/”ę | ČܽāŠŌ | |
| »·¼ŗ“¼ | 100 | 0.961 8 | 161 | Ī¢ČÜÓŚĖ® |
| »·¼ŗĻ© | 82 | 0.810 2 | 83 | ÄŃČÜÓŚĖ® |
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | v£ØB£©=1.5 mol•L-1•min-1 | B£® | v£ØB£©=3 mol•L-1•min-1 | ||
| C£® | v£ØD£©=2 mol•L-1•min-1 | D£® | v£ØC£©=1 mol•L-1•min-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | +7 | B£® | +6 | C£® | +5 | D£® | +4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “óÓŚ0.6mol | B£® | “óÓŚĮć | C£® | µČÓŚ1mol | D£® | ČĪŅāÖµ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com