
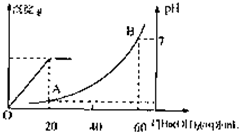
 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A、图中A点溶液的pH=1 | B、生成沉淀的最大质量为2.33g | C、原混合溶液中盐酸物质的量浓度为0.1mol/L | D、当V[Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ |
| n |
| V |
| 0.2mol/L×0.02L |
| 0.02L+0.02L |
| 0.004mol |
| 0.02L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、相同物质的量浓度的醋酸溶液和氢氧化钠溶液等体积混合 | B、相同物质的量浓度的盐酸和氨水等体积混合 | C、pH=3的硫酸溶液和pH=11的氨水等体积混合 | D、pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省武汉市高三二月调研测试理科综合化学试卷(解析版) 题型:选择题
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是

A.图中A点溶液的pH=1
B.生成沉淀的最大质量为2.33g
C.原混合溶液中盐酸物质的量浓度为0.1mol/L
D.当 [Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO
[Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO ═BaSO4↓
═BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com