
【题目】硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜.
已知:2NO2+2NaOH→NaNO3+NaNO2+H2O
NO+NO2+2NaOH→2NaNO2+H2O
(以下涉及到的气体体积均为标准状况下数据):
(1)甲组用a克Cu粉,在加热的条件下,与空气充分反应,然后将生成的CuO全部溶于VmL稀硝酸中,制得硝酸铜溶液,则所需稀硝酸的浓度至少为mol/L,需要质量分数为w%,密度为ρg/cm3的浓硝酸mL(均用最简分式表示).
(2)乙组用b克Cu粉,全部溶于过量的稀硝酸中,溶液质量增重克,将生成的气体通入足量NaOH溶液中并同时通入氧气的体积至少L才能使生成的气体吸收完全(均用最简分式表示).
(3)丙组取某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).列式计算原混合酸中硝酸的物质的量是多少?硫酸的物质的量浓度多少?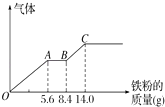
【答案】
(1)![]() ;
;![]()
(2)![]() ;
;![]()
(3)解:由图象可知,由于铁过量,OA段发生反应为:Fe+NO3﹣+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为Fe+2H+=Fe2++H2↑.
OA段发生反应为:Fe+NO3﹣+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,OA段消耗Fe为5.6g,所以n(NO3﹣)=n(Fe)= ![]() =0.1mol,原混合物中硝酸物质的量为0.1mol×2=0.2mol;
=0.1mol,原混合物中硝酸物质的量为0.1mol×2=0.2mol;
最终消耗Fe为14g,此时溶液中溶质为 FeSO4,则n( FeSO4)=n(Fe)= ![]() =0.25mol,由硫酸根守恒n(H2SO4)=n( FeSO4)=0.25mol,则c(H2SO4)=
=0.25mol,由硫酸根守恒n(H2SO4)=n( FeSO4)=0.25mol,则c(H2SO4)= ![]() =2.5mol/L,
=2.5mol/L,
答:原混合酸中硝酸的物质的量是0.2mol,硫酸的浓度为2.5mol/L.
【解析】解:(1)由Cu原子、硝酸根离子守恒可知n(HNO3)=2n[Cu(NO3)2]=2n(Cu)=2× ![]() =
= ![]() mol,则硝酸浓度为
mol,则硝酸浓度为 ![]() =
= ![]() mol/L;根据c=
mol/L;根据c= ![]() 可知,浓硝酸的物质的量浓度为
可知,浓硝酸的物质的量浓度为 ![]() mol/L=
mol/L= ![]() mol/L,需要浓硝酸的体积为
mol/L,需要浓硝酸的体积为 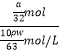 =
= ![]() L=
L= ![]() mL,所以答案是:
mL,所以答案是: ![]() ;
; ![]() ;(2)设溶液质量增重为m,则:
;(2)设溶液质量增重为m,则:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 溶液质量增重
192 192﹣60=132
bg m
所以m= ![]() g=
g= ![]() g,
g,
Cu的物质的量为 ![]() =
= ![]() mol,根据电子转移守恒,生成NO物质的量为
mol,根据电子转移守恒,生成NO物质的量为 ![]() =
= ![]() mol,将NO通入NaOH溶液,同时通入氧气,气体被完全吸收,发生反应NO+NO2+2NaOH=2NaNO2+H2O时需要氧气最少,则NO2的物质的量为
mol,将NO通入NaOH溶液,同时通入氧气,气体被完全吸收,发生反应NO+NO2+2NaOH=2NaNO2+H2O时需要氧气最少,则NO2的物质的量为 ![]() mol×
mol× ![]() =
= ![]() mol,由2NO+O2=2NO2可知,需要通入氧气为
mol,由2NO+O2=2NO2可知,需要通入氧气为 ![]() mol×
mol× ![]() ×22.4L/mol=
×22.4L/mol= ![]() L,
L,
所以答案是: ![]() ;
; ![]() ;
;


科目:高中化学 来源: 题型:
【题目】聚酰胺66是含有肽键的高分子化合物,常用于生产帐篷、渔网等.可用以下方法合成:已知:A与E互为同分异构体,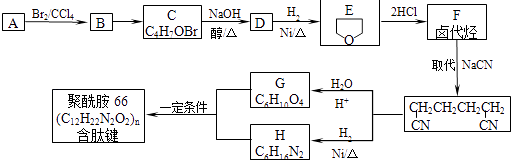
完成下列填空:
(1)A→B的反应类型 , A中含氧官能团的名称 .
(2)B的结构简式 , D可能的结构简式 .
(3)F与氢氧化钠的乙醇溶液共热得到烃I,I的名称 . 比I多一个碳原子的同系物,与等物质的量溴反应生成二溴代物的结构简式正确的是 . a. ![]()
b. ![]()
c. 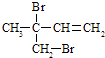
d. 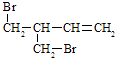
(4)G和H反应生成聚酰胺66的化学方程式: .
(5)同时满足下列条件的G的同分异构体的结构简式为 . ①含一种官能团 ②能发生银镜反应 ③含甲基且有三种化学环境不同的氢原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写及说法正确的是( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890 kJ
B.C(s)+ ![]() O2(g)=CO(g)△H=﹣101.5 kJ?mol﹣1 , 该方程式的△H可表示碳的燃烧热
O2(g)=CO(g)△H=﹣101.5 kJ?mol﹣1 , 该方程式的△H可表示碳的燃烧热
C.Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l)△H=﹣2a kJ?mol﹣1 , 则任何强酸和强碱发生中和反应生成1mol H2O(l)的反应热均为﹣a kJ?mol﹣1
D.2mol氢气燃烧得水蒸气放热484 kJ,则H2O(g)=H2(g)+ ![]() O2(g)△H=+242 kJ?mol﹣1
O2(g)△H=+242 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业炼铁用一氧化碳还原氧化铁时会发生如下一系列反应:
3Fe2O3+CO→2Fe3O4+CO2
Fe3O4+CO→3FeO+CO2
FeO+CO→Fe+CO2
某次实验中,用CO还原4.80g氧化铁,当固体质量变成4.56g时,测得此固体中只存在2种氧化物.则此固体成分和它们的物质的量之比可能的是( )
A.n(FeO):n(Fe3O4)=1:1
B.n(Fe2O3):n(FeO)=2:1
C.n(Fe2O3):n(FeO)=1:2
D.n(Fe2O3):n(Fe3O4)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol 的![]() 中,含有0.6NA个中子
中,含有0.6NA个中子
B. 7.1g Cl2通入足量的NaOH溶液中,反应转移电子的数目为0.2NA
C. 标准状况下,1.12L 的SO3所含的原子数目为0.2NA
D. 将足量的MnO2与含HCl 4 mol的浓盐酸混合后充分加热,生成的气体分子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 硫酸钡不溶于水,所以硫酸钡是非电解质
B. 铜可以导电,所以铜是电解质
C. 氯化钠溶液能导电,所以氯化钠溶液是电解质
D. 液态氯化氢不能导电,但氯化氢是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: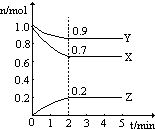
(1)该反应的化学方程式为;
(2)从开始至2min,Z的平均反应速率为;平衡时,X的转化率为 30% ;平衡时,Y的浓度为;
(3)下列叙述能说明该反应已达到化学平衡状态的是(填标号);
A.容器内压强不再发生变化
B.X的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol的Z的同时消耗n mol的Y
E.相同时间内消耗n mol的Y的同时消耗3n mol的X.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2OH++OH﹣△H>0,下列叙述正确的是( )
A.向水中加入氨水,平衡逆向移动,c(OH﹣)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关除杂的实验操作合理的是( )
A.除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃
B.除去氧气中少量氮气:使气体通过炽热的铜粉
C.除去石英中少量碳酸钙:用稀盐酸溶解后过滤
D.除去氯化钠固体中少量的纯碱:加入足量氯化钙,过滤、蒸发、结晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com