
| A. | 稀硫酸:Fe2+、Cl-、NO3-、K+ | B. | 澄清溶液:MnO4-、S2-、Na+、H+ | ||
| C. | 食盐水:K+、NO3-、SO42-、Mg2+ | D. | pH=7的溶液:Na+、HCO3-、SO42-、K+ |
科目:高中化学 来源: 题型:选择题
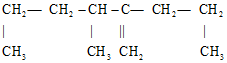 有机物,其正确命名应是( )
有机物,其正确命名应是( )| A. | 2,3-二丙基-1-丁烯 | B. | 2-丙基-3,5-二甲基-1-戊烯 | ||
| C. | 3-甲基-2-丙基-1-己烯 | D. | 3,5-二甲基-2-丙基-1-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量的氨气:NH4+、SO42-、Na+、AlO2- | |
| B. | 加入过量NaHCO3溶液:SO42-、Na+、Al3+、HCO3-、Fe2+ | |
| C. | 加入过量氯水:Cl-、SO42-、Fe3+、Al3+ | |
| D. | 加入过量NaNO3溶液:NO3-、SO42-、Fe2+、Al3+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
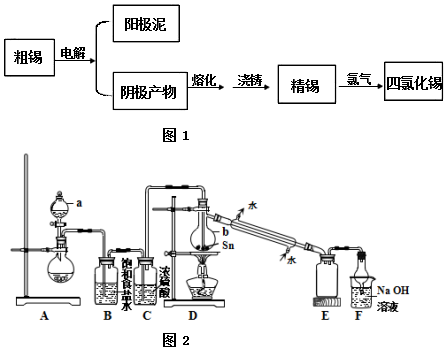
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
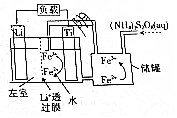
| A. | 左室电解质溶液为含Li+的水溶液 | |
| B. | 放电时,储罐中发生的离子反应为2Fe3++2SO42-═S2O82-+2Fe2+ | |
| C. | 充电时,钛极与外电源的负极相连 | |
| D. | 充电时发生的反应为Li++Fe2+$\frac{\underline{\;电解\;}}{\;}$Li+Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
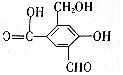 ,试回答下列问题:
,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 戊烷有4种同分异构体 | |
| B. | 乙酸和溴乙烷均可发生加成反应 | |
| C. | 乙烷和乙烯可用酸性KMnO4溶液鉴别 | |
| D. | 皂化反应的产物是高级脂肪酸和甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
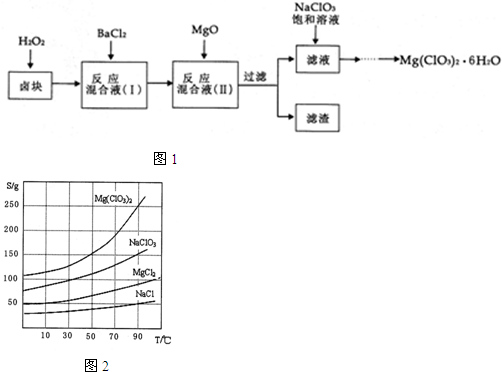
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
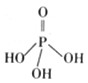 磷单质及其化合物的有广泛应用.
磷单质及其化合物的有广泛应用.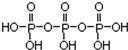 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com