
【题目】电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a;
X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则在X极附近观察到的实验现象是 ;Y电极上的电极反应式为 .若电解过程转移的电子为0.2mol,则X电极上产生的气体体积是 L(标准状况下).
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是 ;Y电极的电极反应式为 .(说明:杂质发生的电极反应不必写出)
【答案】(1)放出气体、溶液变红色;2Cl﹣﹣2e﹣=Cl2↑;2.24;
(2)精铜; Cu﹣2e﹣=Cu2+.
【解析】
试题分析:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,X电极上氢离子放电,同时X电极附近有氢氧根离子生成,导致溶液呈碱性,无色酚酞试液遇碱液变红色;Y电极上氯离子放电生成氯气;
(2)电解精炼粗铜时,粗铜作阳极、纯铜作阴极,阴极上铜离子放电.
解:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,X电极上氢离子放电生成氢气,所以转移的电子为0.2mol,则X电极上产生的气体体积是![]() ×22.4=2.24L,同时X电极附近有氢氧根离子生成,导致溶液呈碱性,无色酚酞试液遇碱液变红色,所以看到的现象是溶液变红色,Y电极上氯离子放电生成氯气,电极反应式为2Cl﹣﹣2e﹣=Cl2↑,
×22.4=2.24L,同时X电极附近有氢氧根离子生成,导致溶液呈碱性,无色酚酞试液遇碱液变红色,所以看到的现象是溶液变红色,Y电极上氯离子放电生成氯气,电极反应式为2Cl﹣﹣2e﹣=Cl2↑,
故答案为:放出气体、溶液变红色;2Cl﹣﹣2e﹣=Cl2↑;2.24;
(2)电解精炼粗铜时,粗铜作阳极、纯铜作阴极,所以X材料为精铜,阴极上铜离子放电,电极反应式为 Cu﹣2e﹣=Cu2+,故答案为:精铜; Cu﹣2e﹣=Cu2+.


科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓H2SO4与浓HNO3的混合酸,加入反应器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
③在50~60℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5% NaOH溶液洗涤,最后再用蒸馏,水洗涤;
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净硝基苯.

请填写下列空白:
(1)配制一定比例浓H2SO4与浓HNO3混合酸时,如何混合? .
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是 ;
(3)装置中常在试管上连接玻璃管,作用是什么? .
(4)步骤④中洗涤、分离粗硝基苯应使用的仪器是 .
(5)步骤④中粗产品用5% NaOH溶液洗涤的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加人稀盐酸,生成气体的量随盐酸加人量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
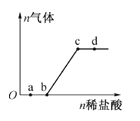
A.a点对应的溶液中:Na+、OH-、SO42-、NO3-
B .b点对应的溶液中:Al3+、Fe3+、NO3-、Cl-
C.c点对应的溶液中:Na+,Ca2+、NO3-、Cl-
D.d点对应的溶液中:Cl-、NO3-、Fe2+ 、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】操作会使H2O的电离平衡向正方向移动,且所得溶液呈酸性的是
A. 向水中加入少量的CH3COONa
B. 向水中加入少量的NaHSO4
C. 向水中加入NaI并加热至100℃,pH=6
D. 向水中加少量的KAl(SO4)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)1 mol分子式为C3H8O的液体有机物A,与足量的金属钠作用,可生成11.2 L氢气(标准状况),则A的分子式必有一个__________基。若A分子中只有一个—CH3,完成(2)(3)中的填空:
(2)A与浓硫酸共热,分子内脱去1分子水生成B。B通入溴水能发生加成反应生成C。A在有铜作催化剂时,与氧气一起加热,发生氧化反应,生成D,D的结构简式为__________;A与金属钠反应有机产物E的结构简式 。
(3)写出下列反应的化学方程式:
①A→B_____________________________________________;
②B→C_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时的最佳顺序为()
①加人少量氯水 ②加人少量KMnO4溶液 ③加人少量KSCN溶液
A.①③ B.③② C.③① D.②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法正确的是
A. 乙醚和乙醇互为同分异构体
B. 糖类、油脂、蛋白质均能发生水解反应
C. 聚氯乙烯可用作生产食品包装材料的原料
D. 分子式为C3H8O的有机物,只有2种能发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学在实验室里对Fe3+与I﹣的反应进行探究,实现Fe3+与Fe2+相互转化.
(1)甲同学首先进行了如下实验:
编号 | 操作 | 现象 |
Ⅰ | 先向2mL0.1molL﹣1FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | ___________________ ___________________ |
Ⅱ | 先向2mL0.1molL﹣1FeCl3溶液中滴加KSCN溶液,再滴加0.1molL﹣1KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加0.1molL﹣1KI溶液后,血红色无明显变化 |
实验Ⅰ中发生反应的离子方程式为 , .
(2)实验II的现象与预测不同,为探究可能的原因,甲同学又进行了如下实验,
操作及现象如下:
编号 | 操作 | 现象 |
Ⅲ | 向2mL0.1molL﹣1KI溶液中滴加1mL 0.1molL﹣1FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
根据实验Ⅲ,该同学认为Fe3+有可能与I﹣发生氧化还原反应.请结合实验现象说明得出该结论的理由: .
(3)乙同学认为,还需要进一步设计实验才可证明根据实验Ⅲ中现象得出的结论.
请补全下表中的实验方案:
编号 | 操作 | 预期现象及结论 |
Ⅳ | 向2mL0.1molL﹣1KI溶液中滴加1mL 0.1molL﹣1 FeCl3,溶液变黄色,取该溶液于两支试管中, 试管①中滴加 , 试管②中滴加 . | 预期现象① , ② . 结论 . |
(4)上述实验结果表明,Fe3+有可能与I﹣发生氧化还原反应.进一步查阅资料知,参加反应的Fe3+和I﹣物质的量相同.该小组同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变血红色的原因,认为Fe3+与I﹣反应的离子方程式应写为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,△H1=﹣393.5kJmol﹣1,△H2=﹣395.4kJmol﹣1,下列说法或表示式正确的是( )
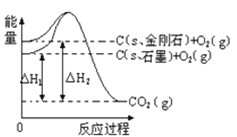
A.C(s、石墨)═C(s、金刚石)△H=﹣1.9 kJmol﹣1
B.石墨的稳定性强于金刚石
C.石墨和金刚石的转化是物理变化
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com