
| 25℃ | pH | 25℃ | pH |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
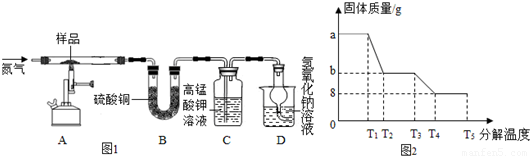
分析 (1)用硫酸亚铁晶体配置FeSO4溶液时要抑制亚铁离子水解和被氧气氧化;
(2)KSCN溶液与Fe3+的溶液反应会使溶液呈血红色,Fe3+有氧化性,能将碘离子氧化成碘单质,碘遇淀粉显蓝色;
(3)依据题中实验过程分析,通入硫化氢至饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=2为了除去杂质离子Sn2+;
(4)①二氧化硫能使高锰酸钾溶液褪色;
②实验中要持续通入氮气,把水蒸气全部赶出,否则测出的x会偏小;
③通过FeSO4•xH2O的化学式可知铁原子和水的个数比为1:2x,根据原子守恒计算.
解答 解:(1)用硫酸亚铁晶体配置FeSO4溶液时要抑制亚铁离子水解和被氧气氧化,所以用硫酸亚铁晶体配置FeSO4溶液时还需加入的物质是少量铁粉和稀硫酸,
故答案为:铁粉和稀硫酸;
(2)KSCN溶液与Fe3+的溶液反应会使溶液呈血红色,Fe3+有氧化性,能将碘离子氧化成碘单质,碘遇淀粉显蓝色,所以检验硫酸亚铁晶体中是否含有Fe3+,可以用KSCN溶液或淀粉-KI溶液,
故选AC;
(3)通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,
故答案为:除去溶液中的Sn2+离子,并防止Fe2+被氧化;防止Fe2+离子生成沉淀;
(4)①二氧化硫能使高锰酸钾溶液褪色,
故答案为:二氧化硫;
②实验中要持续通入氮气,把水蒸气全部赶出,否则测出的x会偏小,
故答案为:偏小;
④通过FeSO4•xH2O的化学式可知铁原子和水的个数比为1:x,
Fe2O3~2xH2O
160 36x
8g 12.6g
x=7
故答案为:7.
点评 本题主要考查了学生根据实验原理从资料中获得有效信息的能力、实验分析能力、根据化学式的计算能力等,难度较大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g | B. | 32 g/mol | C. | 34 g | D. | 34 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 羧酸通常用芳香烃的氧化来制备.芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基.某同学用甲苯的氧化反应制备苯甲酸.反应原理:
羧酸通常用芳香烃的氧化来制备.芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基.某同学用甲苯的氧化反应制备苯甲酸.反应原理:

| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |
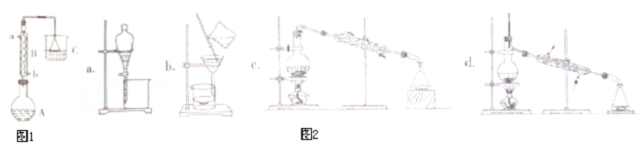
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
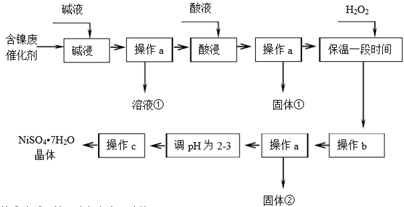
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.8 | 2.7 | 7.6 | 7.1 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2或SO2都会导致酸雨的形成 | |
| B. | 苯与溴水在铁催化下可发生取代反应 | |
| C. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| D. | 电解水生成H2和O2的实验中,可加入少量盐酸增强导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 具有抗菌作用.下列关于七树内酯的叙述正确的是( )
具有抗菌作用.下列关于七树内酯的叙述正确的是( )| A. | 七叶树内酯的分子式为C9H6O4 | B. | 可看成酚类又可看成酯类化合物 | ||
| C. | 能与银氨溶液发生银镜反应 | D. | 最多能与3mol Br2发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com