
对相同状况下的12C18O和14N2两种气体,下列说法正确的是()
A. 若质量相等,则质子数相等
B. 若原子数相等,则中子数相等
C. 若分子数相等,则体积 相等
相等
D. 若体积相等,则密度相等
考点: 阿伏加德罗定律及推论;质量数与质子数、中子数之间的相互关系.
专题: 原子组成与结构专题.
原子组成与结构专题.
分析: 本题需要根据阿伏伽德罗定律及其推论来解答,要针对4个选项中相同的量来分别计算其要求的其他量是否相等.
解答: 解:对于 12C18O和14N2,它们的摩尔质量分别为(12+18)g/mol和(14+14)g/mol,即30g/mol和28g/mol,二者所含质子数分别为6+8=14和7+7=14,所含中子数分别为(12﹣6)+(18﹣8)=16和(14﹣7)+(14﹣7)=14.
A、设质量均为1g,则它们所含质子的物质的量之比为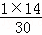 :
: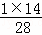 =14:15,因为微粒数之比等于物质的量之比,所以其质子数之比也是14:15,故A错误.
=14:15,因为微粒数之比等于物质的量之比,所以其质子数之比也是14:15,故A错误.
B、二者均为双原子分子,原子数相等时,二者的物质的量相等,其中子数之比为16:14=8:7,即原子数相等时,中子数不相等,故B错误.
C、相同条件时,分子数之比等于物质的量之比等于体积之比,则分子数相等,其体积必然相等,故C正确.
D、相同条件下,密度之比等于摩尔质量之比,其密度之比为30:28=15:14,即体积相等时,其密度不相等,故D错误.
故选C.
点评: 解答本题要熟练记忆阿伏伽德罗定律及其推论,并能把握各自的前提条件,才能灵活运用,学习新课时本类题会成为难点,因此要知难而进,才能突破难点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
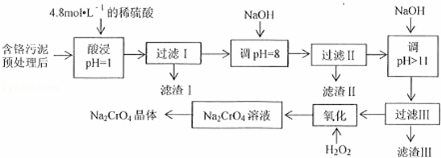
某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺流程如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Mg2+):
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO42﹣形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀是溶液的pH如下:
阳 Fe Mg Al Cr
开始沉淀时的H 1.9 9.0 ﹣﹣ ﹣﹣
沉淀完全时的H 3. 11.1 8 9(>9溶解)
(1)实验室用18.4mol•L﹣1的浓硫酸配制250mL 4.8mol•L﹣1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需量 ;
(2)滤渣II是 ,过滤II步骤能否省略,为什么?
.
(3)写出滤液中加入H2O2发生反应的两种方程式 ;
(4)取得到的Na2CrO4晶体0.48g,加入硫酸溶液得到Na2CrO溶液,用0.3000 mol•L﹣1滴定至终点时(铬被还原为Cr3+),消耗20.00mL标准溶液.
①盛装FeSO4标准溶液应用酸式滴定管(填“酸式”或“碱式”),滴定时的操作为:
②计算该产品中Na2CrO4的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列5 项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液; ⑤加过量的氯化钡溶液.下列正确的操作顺序是()
A. ①④②⑤③ B. ⑤②①④③ C. ④①②⑤③ D. ②⑤④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
用98%的浓H2SO4(ρ=1.84g.cm﹣3)配制1mol/L的稀硫酸100mL,按配制溶液时仪器的选用顺序 排列,选择正确的是()
排列,选择正确的是()
①玻璃棒 ②胶头滴管 ③100mL容量瓶 ④托盘天平 ⑤50mL烧杯 ⑥10mL量筒 ⑦100mL量筒 ⑧移液管 ⑨滴定管.
A. ⑥③⑧⑤①② B. ⑥⑤③①⑨② C. ④⑤③②①⑨ D. ⑥⑤①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
在c(H+):c(OH﹣)=1:2的水溶液中能大量共存的离子组是()
A. K+、Al3+、HCO3﹣、SO42﹣ B. Ca2+、NH4+、CO32﹣、Cl﹣
C. Na+、K+、NO3﹣、ClO﹣ D. Na+、Fe2+、I﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要配制0.1mol•L﹣1 CuSO4溶液480mL.
按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、 、 以及等质量的两片滤纸.
、 以及等质量的两片滤纸.
(2)计算,应选择下列正确
A.需要CuSO4固体8.0g B.需要CuSO4•5H2O晶体12.0g
C.需要CuSO4•5H2O晶体12.5g D.需要CuSO4固体7.7g
(3)称量.所用砝码生锈则所配溶液的浓度会偏高(填“偏高”、“偏低”或“无影响”).
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 .
(5)转移、洗涤.在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了 .
(6)定容,摇匀.
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度.
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶 液的浓度会 (填“偏高”、“偏低”或“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象预测正确的是()
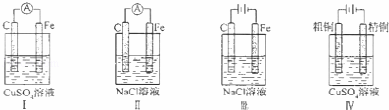
A. 实验Ⅰ:电流表A指针偏转,碳棒上有气泡冒出
B. 实验Ⅱ:电流表A指针偏转,铁极上有无色气体产生
C. 实验Ⅲ:碳棒上有无色气体产生,铁极上有黄绿色气体产生
D. 实验IV:粗铜溶解,精铜上有红色固体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是()
A. Cu能与浓硝酸反应,而不与浓盐酸反应
B. Cu与浓硝酸反应比与稀硝酸反应快
C. N2与O2在常温、常压下不反应,放电时可反应
D. Fe与浓盐酸反应快,与稀盐酸反应慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com