
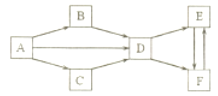
【题目】A-F为中学化学常见物质,它们的焰色实验均为黄色。其中A为单质,B与C的组成元素相同,且B为淡黄色固体;D、E、F的溶液均显碱性,其中E和F属于盐,E被广泛用于玻璃、造纸和纺织等。它们之间的相互转化关系如下图。(“”表示一步反应即可转化,部分反应物、生成物和反应条件已略去)
请回答下列问题:
(1)写出下列物质的化学式:B___,C___,E___。
(2)AD的化学方程式是___。
(3)BD的化学方程式是___。
(4)区分E和F两种固体的方法是:分别取等量的E和F两种固体少许于试管中,操作,现象和结论是___。
【答案】Na2O2 Na2O Na2CO3 2Na + 2H2O = 2NaOH + H2 2Na2O2 + 2H2O = 4NaOH + O2 加热试管,将导气管插入澄清石灰水中, E试管的澄清石灰水没有明显变化, F试管的澄清石灰水变浑浊,说明 F 是 NaHCO3, E 是 Na2CO3(或向两试管中分别加入等量的CaCl2溶液 ,E试管中产生白色沉淀, F试管中无明显现象)
【解析】
A-F为中学化学常见物质,它们的焰色实验均为黄色,因此都含有钠元素。其中A为单质,A是钠;B与C的组成元素相同,且B为淡黄色固体,则B是过氧化钠,C氧化钠;D、E、F的溶液均显碱性,其中E和F属于盐,E被广泛用于玻璃、造纸和纺织等,则E是碳酸钠,F是碳酸氢钠,根据它们之间的相互转化关系可知A、B、C均能转化为D,所以D是氢氧化钠。据此解答。
根据以上分析可知A是钠,B是过氧化钠,C氧化钠,D是氢氧化钠,E是碳酸钠,F是碳酸氢钠,则
(1)B、C、E的化学式分别是Na2O2、Na2O、Na2CO3。
(2)A→D是钠与水反应生成氢氧化钠和氢气,反应的化学方程式是2Na+2H2O=2NaOH+H2↑。
(3)B→D是过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式是2Na2O2+2H2O=4NaOH+ O2↑。
(4)区分碳酸钠和碳酸氢钠两种固体的方法是:分别取等量的碳酸钠和碳酸氢钠两种固体少许于试管中,加热试管,将导气管插入澄清石灰水中,E试管的澄清石灰水没有明显变化,F试管的澄清石灰水变浑浊,说明F是NaHCO3,E是Na2CO3,或向两试管中分别加入等量的CaCl2溶液,E试管中产生白色沉淀,F试管中无明显现象,说明F是NaHCO3,E是Na2CO3。


科目:高中化学 来源: 题型:
【题目】下列有关碳酸氢钠和碳酸钠的说法正确的是( )
A.加热时均可以分解产生气体
B.与盐酸反应的离子反应方程式一样
C.都可以与硫酸反应生成气体
D.碳酸钠俗称小苏打
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
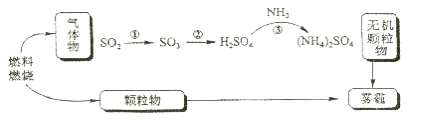
【题目】研究表明,二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。
请回答下列问题。
(1)雾霾是雾和霾的组合词,二者的分散剂都是________________,雾霾的一种分散质的化学式是____________
(2)燃烧后引起雾霾的一种化石燃料是___________, SO2 还能导致的一种环境问题是_________________
(3)①的化学方程式为____________,其中氧化剂与还原剂的物质的量之比为_____________
(4)工业合成氨的化学方程式为_____________________________, NH3 的一种用途为___________________
(5)鉴别 SO2 和 NH3的方法是_________________________,若观察到____________,则证明气体是 SO2,反之,气体是 NH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
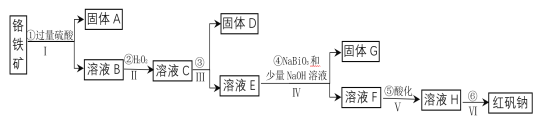
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-,自身被还原为Bi(OH)3固体。
ii.
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)将铬铁矿矿石粉碎的目的是________________________________________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式_____________________________________________。
(4)⑤中酸化是使CrO42-转化为Cr2O72-![]() 写出该反应的离子方程式______。
写出该反应的离子方程式______。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
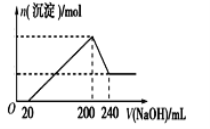
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A.Fe3O4与HI反应的离子方程式为:Fe3O4+8H++2I—=3Fe2++I2+4H2O
B.用稀H2SO4除去铜绿:4H++Cu2(OH)2CO3=2Cu2++CO2↑+3H2O
C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42—完全沉淀:
2Ba2++Al3++2SO42—+4OH—=AlO2—+2H2O+2BaSO4↓
D.少量Ca(OH)2溶液与NaHCO3混合:Ca2++2OH—+2HCO3—=CaCO3↓+2H2O+CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用水蒸气蒸馏的方法(蒸馏装置如图)从植物组织中获取挥发性成分。这些挥发性成分的混合物统称精油,大都具有令人愉快的香味。从柠檬、橙子和柚子等水果的果皮中提取的精油90%以上是柠檬烯(柠檬烯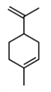 )。提取柠檬烯的实验操作步骤如下:
)。提取柠檬烯的实验操作步骤如下:
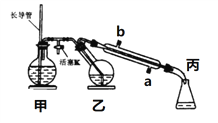
(1)将1~2个橙子皮剪成细碎的碎片,投入乙装置中,加入约30 mL水
(2)松开活塞K。加热水蒸气发生器至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧,打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。
下列说法不正确的是( )
A. 当馏出液无明显油珠,澄清透明时,说明蒸馏完成
B. 蒸馏结束后,为防止倒吸,立即停止加热
C. 长玻管作安全管,平衡气压,防止由于导管堵塞引起爆炸
D. 要得到纯精油,还需要用到以下分离提纯方法:萃取、分液、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸中二氧化硫的催化氧化原理为:2SO2(g)+O2(g)![]() 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是

A. 在A、B、C三点时,V(正)=v(逆),在D点时V(正)>v(逆)
B. A、B、C三点的平衡常数一定不相同
C. 升高温度可以加快化学反应速率,有利于平衡向正反应方向移动
D. 一定温度下,保持容器体积不变,向平衡体系中通人稀有气体,压强增大,平衡不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com