
| A. | 向溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,说明一定含有SO${\;}_{4}^{2-}$ | |
| B. | 向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有气体逸出,说明一定存在CO32-和AlO${\;}_{2}^{-}$ | |
| C. | 用焰色反应检验时,透过蓝色钴玻璃观察火焰呈紫色,则说明含有K+没有Na+ | |
| D. | 取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12,说明不存在NH${\;}_{4}^{+}$、Al3+、Cu2+ |
分析 A,阴离子SO32-、NO3-和H+在溶液中会发生氧化还原反应生成硫酸根离子,硫酸根离子结合钡离子生成硫酸钡白色沉淀;
B.AlO2-离子和氢离子结合会生成氢氧化铝白色沉淀,继续滴加氢氧化铝溶于盐酸沉淀消失,生成气体的阴离子可能为SO32-、CO32-;
C.蓝色钴玻璃能滤去黄光;
D.取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12,溶液呈碱性,溶液中一定不存在Al3+、Cu2+、NH4+;
解答 解:A.NO3-和H+在溶液中形成稀硝酸具有氧化性,原溶液中亚硫酸根离子具有还原性,能被氧化生成硫酸根离子,也会生成不溶于酸的白色硫酸钡沉淀,不一定含硫酸根离子,故A错误;
B.向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,AlO2-离子和氢离子结合会生成氢氧化铝白色沉淀,继续滴加氢氧化铝溶于盐酸沉淀消失,同时有气体逸出,生成气体的阴离子可能为SO32-、CO32-,故B错误;
C.蓝色钴玻璃能滤去黄光,故透过蓝色钴玻璃观察火焰呈紫色,说明该溶液中一定含K+,但还可能含钠离子,故C错误;
D.取该粉末,加水后得到无色溶液,一定无铜离子,且未嗅到气味;用pH试纸测得溶液的pH为12,说明溶液显碱性,则铝离子、铵根离子不存在,溶液中一定不存在Al3+、Cu2+、NH4+,故D正确;
故选D.
点评 本题考查了离子检验的实验方法和反应现象分析判断,离子共存的分析应用,离子性质是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | MoS2煅烧产生的尾气可直接排到空气中 | |
| B. | MoO3不溶于氢氧化钠溶液 | |
| C. | H2MoO4是一种强酸 | |
| D. | 利用H2、CO和Al分别还原等量的MoO3,消耗还原剂的物质的量之比为3:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为7、中子数为8的氮原子:87N | |
| B. | 溴化铵的电子式: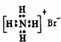 | |
| C. | 乙酸的比例模型: | |
| D. | 间硝基甲苯的结构简式: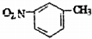 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | ① | ② | ③ | ④ |
| 盐酸体积/mL | 50 | 50 | 50 | 50 |
| 固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
| 生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
| A. | 实验②中,混合物过量 | |
| B. | 原混合物样品中 n(Na2CO3):n(KHCO3)=1:1 | |
| C. | 盐酸的物质的量浓度为 2 mol•L-1 | |
| D. | 实验④反应后,至少需继续加入 40ml 的该盐酸溶液才能把12.24g的混合物全部反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 可能是甲烷和丁烷的混合物 | B. | 可能是甲烷和戊烷的混合物 | ||
| C. | 可能是丁烷和异丁烷的混合物 | D. | 可能是乙烷和丙烷的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸的摩尔质量与6.02×1023个硫酸分子的质量在数值上相等 | |
| B. | 6.02×1023个氮分子和6.02×l023个氢分子的质量比等于14:1 | |
| C. | 32g氧气所含的原子数目约为1.204×1024 | |
| D. | O2、SO2、SO3三者的质量比为2:4:5时,它们的物质的量之比为2:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
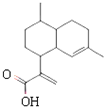
| A. | 青蒿酸分子式为:C15H20O2 | |
| B. | 在一定条件,可与乙醇发生酯化反应 | |
| C. | 1 mol青蒿酸可与3 mol H2发生加成反应 | |
| D. | 能使溴水褪色,不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com