
| A. | A>B>C>D | B. | C>A>B>D | C. | A>C>D>B | D. | B>D>C>A |
分析 活泼性较强的金属作原电池的负极,易失去电子而被氧化;原电池中电子从负极流经外电路流向正极,金属的活泼性只取决于失电子的能力,与失电子多少无关,以此解答该题.
解答 解:①活泼性较强的金属作原电池的负极,A、B用导线相连后,同时插入稀H2SO4中,A极为负极,则活泼性:A>B;
②原电池中电子从负极流经外电路流向正极,B、C用导线相连后,B极发生氧化反应,则活泼性:B>C;
③原电池中电子从负极流经外电路流向正极,C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D,则活泼性:C>D;
所以有:A>B>C>D,
故选A.
点评 本题考查金属活泼性的比较,为高频考点,题目难度不大,本题注意把握如何从原电池的角度比较金属的活泼性,注意原电池中,较为活泼的金属作负极.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
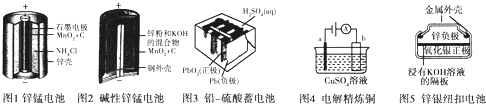
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19 | B. | 30 | C. | 45 | D. | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
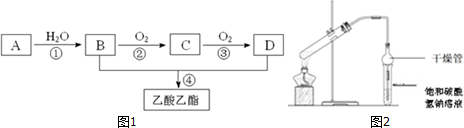
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
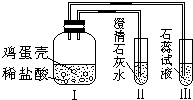 某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )
某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )| A. | 鸡蛋壳发生了分解反应 | |
| B. | Ⅰ中发生的现象为鸡蛋壳逐渐溶解,产生大量气泡 | |
| C. | II中的澄清石灰水变浑浊 | |
| D. | III中紫色石蕊试液变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com