
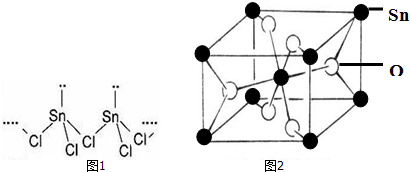
分析 (1)Sn属于ⅣA族元素,价电子排布式为ns2np2,位于第5周期,可确定其价电子排布式;
(2)配位键为Sn提供空轨道,Cl提供孤对电子,根据图1可知形成两条共价键的Cl,其中一条为配位键;
(3)判断两种化合物晶体类型,根据微粒间相互作用判断熔沸点;
(4)利用均摊法计算;
(5)根据白锡和灰锡的配位数和空间想象能力,判断密度;
解答 解:(1)Sn属于ⅣA族元素,价电子排布式为ns2np2,位于第5周期,可确定其价电子排布式为:5s25p2,
故答案为:5s25p2;
(2)配位键为Sn提供空轨道,Cl提供孤对电子,根据图1可知形成两条共价键的Cl,其中一条为配位键,配位键表示为由形成两条共价键的Cl指向Sn;
故答案为:共价键、配位键;
(3)SnCl4与CCl4都属于分子晶体,所以相对分子质量较大的分子,范德华力大,熔沸点较高,
故答案为:SnCl4;SnCl4相对分子质量大,范德华力大;
(4)O位于体心和面心,数目为2+4×=4,Sn位于顶点和体心,数目为8×+1=2,原子数目比为2:1,化学式为SnO2;
故答案为:SnO2;
(5)白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似,配位数为4,前者配位数较大,其空间利用率较大,所以其密度大于灰锡,
故答案为:配位数大,空间利用率大.
点评 本题主要考查了物质的结构,涉及到价电子排布式、化学键、熔沸点比较以及有关晶体的计算,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 把CaO放入水中:CaO=Ca2++O2- | |
| B. | 加热NaHSO4至熔化:NaHSO4=Na2++H++SO42- | |
| C. | 把Mg(OH)2放入水中:Mg(OH)2=Mg2++2OH- | |
| D. | 把NaCl放入水中:NaCl=Na++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A、B、C三种短周期元素在周期表中的相对位置如图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )
A、B、C三种短周期元素在周期表中的相对位置如图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )| A. | B与C均不存在同素异形体 | B. | X一定是酸性氧化物 | ||
| C. | B的氢化物比A、C的氢化物稳定 | D. | A与B形成的化合物X有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4═2H++SO | B. | H3PO4?3H++PO | ||
| C. | NaHCO3═Na++H++CO | D. | CaCO3?Ca2++CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H | B. | Cl | C. | Na | D. | K |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制90mL1.00mol/L的NaCl溶液,用托盘天平称取5.3gNaCl固体 | |
| B. | 用蒸发方法使NaCl从溶液中析出时,应当坩埚中有大量固体析出时移走酒精灯用余热蒸干 | |
| C. | 先在天平两个托盘上各放一张相同质量的滤纸,再把氢氧化钠固体放在滤纸上称量 | |
| D. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com