
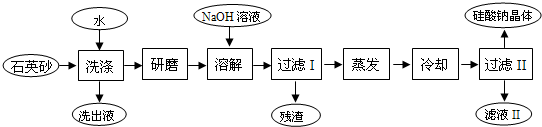
 2Fe+Al2O3;
2Fe+Al2O3; 2Fe+Al2O3 ;
2Fe+Al2O3 ;

科目:高中化学 来源: 题型:解答题
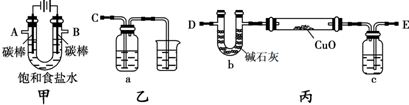
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
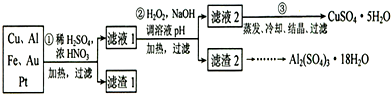
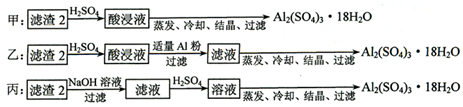
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 CaO+CO2↑
CaO+CO2↑ 2Fe+3CO2
2Fe+3CO2查看答案和解析>>
科目:高中化学 来源: 题型:单选题
| 选项 | 陈述I | 陈述Ⅱ |
| A | SO3可与水反应 | 工业生产硫酸用水吸收SO3 |
| B | Cl2和SO2都有较好的漂白作用 | Cl2和SO2混合后可用于漂白纸浆 |
| C | 铝的最外层电子较钠多 | 钠的金属性强于铝 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com