
(11分)X、Y、Z、V、W为五种前四周期元素,其中X是短周期(除稀有气体外)原子半径最大的元素;Y与X同周期,其最高价氧化物的水化物呈两性;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为ls22s22p63s2;W的原子序数为29,W的离子能与乙二胺(H2N—CH2—CH2—NH2)形成配离子: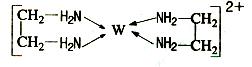
回答下列问题:
(1)W原子的核外电子排布式为 ,该配离子中含有的化学键类型有 。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(2)元素X、Y、V第一电离能由大到小的顺序是 (用元素符号表示)。
(3)Z的氢化物的空间构型是 ;该氢化物的沸点比甲烷的高,其主要原因是
(4)一定压强,将HF和HCl混合气体降温时,首先液化的物质是
(5)已知XeO3分子中氙原子上有1对孤对电子,则XeO3为_________分子(填“极性”或
“非极性”);XeO3分子中中心原子的杂化类型为 ;XeO3分子实际空间构型为
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
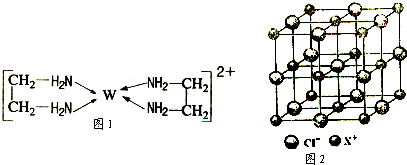
【化学——选修3:物质结构与性质】(15分)X、Y、Z、V、W为五种前四周期元素,其中X是短周期(除稀有气体外)原子半径最大的元素;Y与X同周期,其最高价氧化物的水化物呈两性;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为ls22s22p63s2;W的原子序数为29,W的离子能与乙二胺(H2N—CH2一CH2一NH2)形成配离子:
回答下列问题:
(1)W原子的核外电子排布式为 ,该配离子中含有的化学键类型有 。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(2)元素X、Y、V第一电离能由大到小的顺序是 (用元素符号表示)。
(3)Z的氢化物的空间构型是 ;该氢化物的沸点比甲烷的高,其主要原因是 ;Z的另一种氢化物Z2H4分子中Z原子轨道的杂化类型是 。
(4)X和Cl元素构成的化合物XCl,XCl的晶胞结构如右图所示,晶体中X+的配位数是 ;每个X+周围与其紧邻的Cl-围成的几何图形为 。
查看答案和解析>>
科目:高中化学 来源:2012届河北省唐山市高三上学期期末统一考试理综试题化学试卷(解析版) 题型:单选题
【化学——选修3:物质结构与性质】(15分)X、Y、Z、V、W为五种前四周期元素,其中X是短周期(除稀有气体外)原子半径最大的元素;Y与X同周期,其最高价氧化物的水化物呈两性;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为ls22s22p63s2;W的原子序数为29,W的离子能与乙二胺(H2N—CH2一CH2一NH2)形成配离子: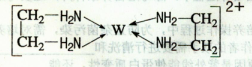
回答下列问题:
(1)W原子的核外电子排布式为 ,该配离子中含有的化学键类型有 。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(2)元素X、Y、V第一电离能由大到小的顺序是 (用元素符号表示)。
(3)Z的氢化物的空间构型是 ;该氢化物的沸点比甲烷的高,其主要原因是 ;Z的另一种氢化物Z2H4分子中Z原子轨道的杂化类型是 。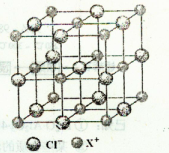
(4)X和Cl元素构成的化合物XCl,XCl的晶胞结构如右图所示,晶体中X+的配位数是 ;每个X+周围与其紧邻的Cl-围成的几何图形为 。
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二下学期三调考试化学试卷(解析版) 题型:填空题
(11分)X、Y、Z、V、W为五种前四周期元素,其中X是短周期(除稀有气体外)原子半径最大的元素;Y与X同周期,其最高价氧化物的水化物呈两性;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为ls22s22p63s2;W的原子序数为29,W的离子能与乙二胺(H2N—CH2—CH2—NH2)形成配离子:
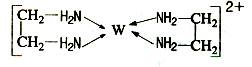
回答下列问题:
(1)W原子的核外电子排布式为 ,该配离子中含有的化学键类型有 。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(2)元素X、Y、V第一电离能由大到小的顺序是 (用元素符号表示)。
(3)Z的氢化物的空间构型是 ;该氢化物的沸点比甲烷的高,其主要原因是
(4)一定压强,将HF和HCl混合气体降温时,首先液化的物质是
(5)已知XeO3分子中氙原子上有1对孤对电子,则XeO3为_________分子(填“极性”或
“非极性”);XeO3分子中中心原子的杂化类型为 ;XeO3分子实际空间构型为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com