
 ,与④的氢化物相比较,N的氢化物更稳定.
,与④的氢化物相比较,N的氢化物更稳定.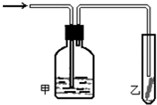
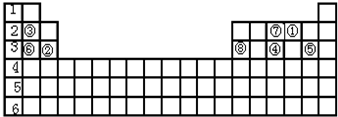
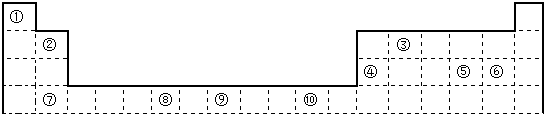
分析 由元素在周期表中位置,可知①为O、②为Mg、③为Li、④为P、⑤为Cl、⑥为Na、⑦为N、⑧为Al.
(1)⑦元素的气态氢化物为NH3,分子中氮原子与氢原子之间形成1对共用电子对;非金属性越强,氢化物越稳定;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;最高价氧化物对应水化物酸性最强的是高氯酸;氨气溶液呈碱性;
(3)⑧元素的最高价氧化物对应水化物为Al(OH)3,有酸式电离与碱式电离两种情况,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水;
(4)最终红色布条不褪色,说明甲装置内盛放的液体应与氯气发生反应或可以干燥氯气.
解答 解:由元素在周期表中位置,可知①为O、②为Mg、③为Li、④为P、⑤为Cl、⑥为Na、⑦为N、⑧为Al.
(1)⑦元素的气态氢化物为NH3,电子式为 ,由于N元素非金属性比P的强,故氨气更稳定,
,由于N元素非金属性比P的强,故氨气更稳定,
故答案为: ;N;
;N;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故上述元素中Na原子半径最大;最高价氧化物对应水化物酸性最强的是高氯酸;氨气溶液呈碱性,
故答案为:Na;Cl;N;
(3)⑧元素的最高价氧化物对应水化物为Al(OH)3,电离方程式为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-;Al(OH)3+OH-=AlO2-+2H2O;
(4)最终红色布条不褪色,说明甲装置内盛放的液体应与氯气发生反应或可以干燥氯气,NaOH溶液、KI溶液能与氯气反应,浓硫酸干燥氯气,饱和氯化钠溶液不能完全吸收氯气,故答案为:abc.
点评 本题元素周期表与元素周期律应用,难度不大,理解掌握元素周期律,(4)中注意干燥的氯气不具有漂白性.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 锗的第一电离能高于碳而电负性低于碳 | |
| B. | 乙烯分子中,只有一个碳碳π键,四个碳氢σ键 | |
| C. | 在铁制品上镀铜时,镀件为阳极,铜盐溶液为电镀液 | |
| D. | 甲醇分子内的O-C-H键角小于甲醛分子内O-C-H键角 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 试剂 | 离子反应方程式 | |
| ①NaHCO3溶液(Na2CO3) | CO2 | CO2+H2O+CO32-=2HCO3- |
| ②Fe2O3(Al2O3) | NaOH溶液 | Al2O3+2OH-=2AlO2-+H2O |
| ③FeCl3溶液(FeCl2) | Cl2 | 2Fe2++Cl2=2Fe3++2Cl- |
| ④CO2(HCl) | 饱和的NaHCO3溶液 | HCO3-+H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
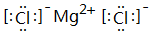 ,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.
,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.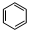 +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$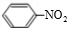 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
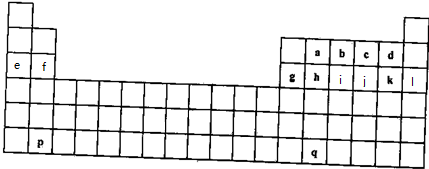
 .
. ;⑥和⑦形成的化合物电子式为
;⑥和⑦形成的化合物电子式为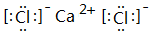 .③和⑥形成的化合物晶体类型为分子晶体.元素①的4个原子与元素③的2个原子形成的分子中含有σ键的数目为5,π键数目为1.
.③和⑥形成的化合物晶体类型为分子晶体.元素①的4个原子与元素③的2个原子形成的分子中含有σ键的数目为5,π键数目为1.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气能在氧气中燃烧,说明氧气具有可燃性 | |
| B. | 水通电分解时生成氢气和氧气,说明水是由氢气和氧气组成 | |
| C. | 将石蕊试液滴入稀硫酸中溶液显红色,说明石蕊试液能使酸变红 | |
| D. | 通过在显微镜下观察木炭,得知木炭具有疏松多孔的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ②③④⑤⑥① | C. | ④⑤⑥②①③ | D. | ⑥④①②⑤③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com