
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
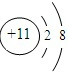 .
.分析 T失去一个电子后,形成Ne原子电子层结构,则T含有11个电子,为Na;X的最外层电子数是次外层电子数的2倍,则X为C;Y的单质之一是空气中主要成分,最常见的助燃剂,则Y为O;Z形成双原子单质分子,黄绿色气体,则Z为Cl;然后结合问题分析.
解答 解:T失去一个电子后,形成Ne原子电子层结构,则T含有11个电子,为Na;X的最外层电子数是次外层电子数的2倍,则X为C;Y的单质之一是空气中主要成分,最常见的助燃剂,则Y为O;Z形成双原子单质分子,黄绿色气体,则Z为Cl;
(1)元素X为C,它的一种同位素用来作原子量标准,这种同位素的符号是14C,
故答案为:14C;
(2)a原子中含有11个质子,核外11个电子,分三层排布,其原子结构示意图为: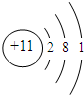 ;所以离子的结构示意图为:
;所以离子的结构示意图为: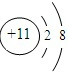 ,故答案为:
,故答案为: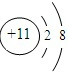 ;
;
(3)工业上制取氯气大多采用电解饱和食盐水的方法电解饱和食盐水反应生成NaOH、H2、Cl2,该反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
若忽略100mL溶液反应一段时间后的体积变化,Z离子浓度由8mol/L变为6mol/L,所以放电的氯离子的物质的量为:0.8-0.6=0.2mol,则生成氯气和氢气各0.1mol,所以气体的总体积为:(0.1+0.1)mol×22.4L/mol=4.48L,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;4.48L.
点评 本题考查了元素的推断,注意把握原子结构与元素的性质的关系,题目难度不大,侧重于基础知识的考查,注意知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:K+、NO3-、SO32-、Na+ | |
| B. | 使石蕊呈红色的溶液中:Na+、HCO3-、NO3-、AlO2- | |
| C. | 使pH试纸显红色的溶液中:Cu2+、Fe3+、NO3-、SO42- | |
| D. | 在酸性溶液中:NH4+、Na+、Cu2+、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
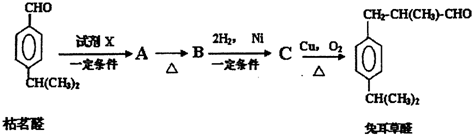

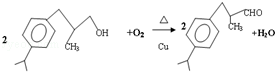 .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
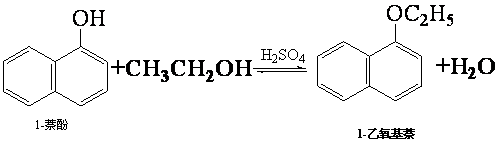
| 物质 | 相对分 子质量 | 状态 | 熔点(℃) | 沸点(℃) | 溶解度 | |
| 水 | 乙醇 | |||||
| 1-萘酚 | 144 | 无色或黄色菱形结晶或粉末 | 96℃ | 278℃ | 微溶于水 | 易溶于乙醇 |
| 1-乙氧基萘 | 172 | 无色液体 | 5.5℃ | 267℃ | 不溶于水 | 易溶于乙醇 |
| 乙醇 | 46 | 无色液体 | -114.1℃ | 78.5℃ | 任意比混溶 | |
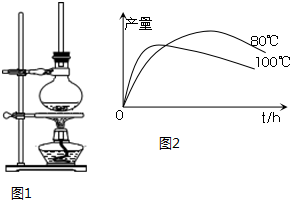
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
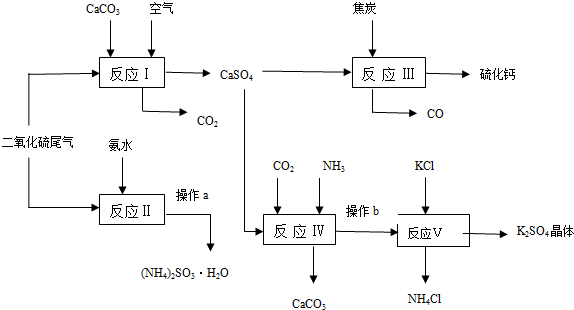
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com