
 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:分析 (1)①甲池为原电池,乙池为电解池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,发生还原反应;
②乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,阳极上氢氧根离子放电;
(2)①根据电解池的工作原理来书写电解氯化钠的原理方程式;
②甲池为原电池,碳棒做正极,正极上得电子发生还原反应;
③将湿润的KI淀粉试纸放在乙池石墨电极附近,发现试纸变蓝,则石墨电极上氯离子失电子生成氯气,氯气和碘化钾发生氧化还原反应生成碘,碘与淀粉试液变蓝色;
④根据转移电子守恒计算生成的氢氧化钠的物质的量,再根据水的离子积常数计算溶液中氢离子浓度,从而得出溶液的pH.
解答 解:(1)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出,乙池为电解池,外电路电子流向电源正极,所以碳棒为阳极,放出氯气,阴极铁电极上发生还原反应有Cu析出,
故答案为:碳;铁;
②乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,
故答案为:4OH--4e-=O2↑+2H2O;
(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极为阳极电解氯化钠溶液,方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
②甲池中碳棒为正极,正极上氧气得电子发生还原反应,电极反应式为:2H2O+O2+4e-═4OH-,乙池中碳棒为阳极,阳极发生氧化反应,故答案为:2H2O+O2+4e-═4OH-;氧化反应;
③将湿润的KI淀粉试纸放在乙池石墨电极附近,发现试纸变蓝,则石墨电极上氯离子失电子生成氯气,氯气和碘离子反应生成碘单质,碘遇淀粉试液变蓝色,反应方程式为:2KI+Cl2=I2+2KCl,故答案为:2KI+Cl2=I2+2KCl;
④电解氯化钠溶液的方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,乙池转移0.02mole-后,会生成0.02mol的氢氧化钠,所以所得NaOH溶液的物质的量浓度c=$\frac{n}{V}$=$\frac{0.02mol}{0.2L}$=0.1mol/L,所以溶液中氢离子浓度=$\frac{1{0}^{-14}}{0.1}$,所以溶液的pH=13,
故答案为:13.
点评 本题考查原电池和电解原理,明确工作原理及发生的电极反应是解答的关键,注意电极的判断和电子守恒的应用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 溶液的浓度变为0.08 mol•L-1 | B. | 阳极上产生112 mL O2(标准状况) | ||
| C. | 转移的电子数是1.204×1022 | D. | 反应中有0.02 mol的Ag被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | 食盐水 | C. | 酒精 | D. | 溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
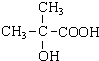 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加大石油、煤炭的开采速度,增加化石燃料的供应量 | |
| B. | 推广使用燃煤脱硫技术,防治SO2污染 | |
| C. | 研制开发燃料电池汽车,消除机动车尾气污染 | |
| D. | 实施绿化工程,防治扬尘污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在粗硅的制取中发生反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,所以非金属性C>Si | |
| B. | 由Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CO2↑+Na2SiO3可知硅酸的酸性大于碳酸 | |
| C. | 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2 | |
| D. | 由H2S+CuSO4═CuS↓+H2SO4可知,氢硫酸的酸性比硫酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正常雨水的pH为7.0,酸雨的pH小于7.0 | |
| B. | 严格执行机动车尾气排放标准有利于防止大气污染 | |
| C. | 使用二氧化硫和某些含硫化合物漂白食品会对人体健康产生危害 | |
| D. | PM 2.5是指大气中直径≤2.5微米的颗粒物,戴普通口罩还是对人体健康有影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com