
分析 发生反应:CaCO3+2HCl=CaCl2+H2O+CO2↑,根据n=$\frac{V}{{V}_{m}}$计算二氧化碳物质的量,根据方程式计算碳酸钙物质的量,再根据m=nM计算碳酸钙质量.
解答 解:①碳酸钙与盐酸发生反应:CaCO3+2HCl=CaCl2+H2O+CO2↑,
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
②标况下22.4mL 二氧化碳的物质的量为$\frac{0.0224L}{22.4L/mol}$=0.001mol
CaCO3+2HCl=CaCl2+H2O+CO2↑
1 1
n(CaCO3) 0.001mol
所以n(CaCO3)=$\frac{0.001mol×1}{1}$=0.001mol
故m(CaCO3)=0.001mol×100g/mol=0.1g
故答案为:0.1.
点评 本题考查化学方程式有关计算,比较基础,旨在考查学生对基础知识的理解掌握.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期ⅥB族;p区 | B. | 第三周期ⅢB族;ds区 | ||
| C. | 第四周期ⅥB族;d区 | D. | 第四周期ⅢB族;f区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐水是电解质 | |
| B. | 氯化氢是电解质,所以液态氯化氢导电,气态氯化氢不导电 | |
| C. | CuSO4是电解质,CuSO4•5H2O不是电解质 | |
| D. | 蔗糖、乙醇等多数有机化合物和非金属氧化物都是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$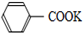 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O +HCl→
+HCl→ +KCl
+KCl
| A. | 上述反应原理的两个反应都是氧化还原反应 | |
| B. | 操作Ⅰ是蒸馏,操作Ⅱ是分液 | |
| C. | 无色液体A是甲苯,白色固体B主要成分是苯甲酸 | |
| D. | 无色液体A是苯甲酸,白色固体B主要成分是甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,沉淀C的化学式为:BaSO4,沉淀G的化学式为:Fe(OH)3.
,沉淀C的化学式为:BaSO4,沉淀G的化学式为:Fe(OH)3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com