
【题目】已知甲基丙烯酸缩水甘油酯(GMA)主要用于高分子胶囊、离子交换树脂和印刷油墨的粘合剂。其合成路线如下:

请回答下列问题:
(1)GMA中的官能团名称是_________________________________。
(2)甘油的结构简式是___________,F的结构简式___________。
(3)请写出B→C、D→E的化学方程式,并判断反应类型:
B→C:_________________________________、___________反应;
D→E:_________________________________、___________反应。
(4)E的核磁共振氢谱峰面积之比由大到小为___________,E的同分异构体中能发生水解反应的链状化合物有___________种。
(5)已知CH2=CH2能在Ag作催化剂的条件下与O2反应生成![]() ,据此请设计一条由丙烯生成F的路线。____________________________________________。
,据此请设计一条由丙烯生成F的路线。____________________________________________。
【答案】碳碳双键、酯基和醚键 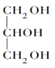
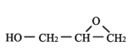
 氧化
氧化 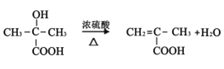 消去 3:2:1 5
消去 3:2:1 5 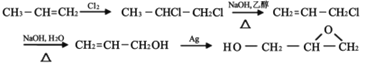
【解析】
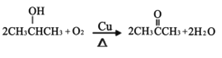
由GMA结构简式和题给框图可知,丙烯(CH3CH=CH2)与HCl发生加成反应生成CH3CH(Cl)CH3,则A为CH3CH(Cl)CH3;CH3CH(Cl)CH3在氢氧化钠溶液中加热发生水解反应生成CH3CH(OH)CH3,CH3CH(OH)CH3发生催化氧化反应生成![]() ,则C为
,则C为![]() ;
;![]() 发生信息反应生成
发生信息反应生成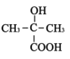 ,则D为
,则D为 ;
; 在浓硫酸加热条件下发生消去反应生成
在浓硫酸加热条件下发生消去反应生成![]() ,则E为
,则E为![]() ;由E和GMA结构简式可知,F为
;由E和GMA结构简式可知,F为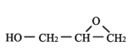 。
。
(1)GMA结构简式为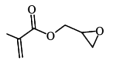 ,其含有的官能团为碳碳双键、酯基和醚键,故答案为:碳碳双键、酯基和醚键;
,其含有的官能团为碳碳双键、酯基和醚键,故答案为:碳碳双键、酯基和醚键;
(2)甘油为丙三醇,结构简式是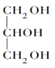 ;由E和GMA结构简式可知,F为
;由E和GMA结构简式可知,F为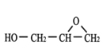 ,故答案为:
,故答案为: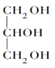 ;
;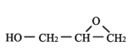 ;
;
(3)B→C的反应为CH3CH(OH)CH3发生催化氧化反应生成![]() ,反应的化学方程式为
,反应的化学方程式为 ;D→E的反应为
;D→E的反应为 在浓硫酸加热条件下发生消去反应生成
在浓硫酸加热条件下发生消去反应生成![]() ,反应的化学方程式为
,反应的化学方程式为 ,故答案为:
,故答案为: ;氧化;
;氧化; ;消去;
;消去;
(4)E为![]() ,其核子共振氢谱有3组峰,面积为3:2:1;E的同分异构体中能发生水解反应的链状化合物应为酯,可能为甲酸酯、乙酸酯和丙烯酸酯,若为甲酸酯有3种、若为乙酸酯有1种、若为丙烯酸酯有1种,共有5种,故答案为:3:2:1;5;
,其核子共振氢谱有3组峰,面积为3:2:1;E的同分异构体中能发生水解反应的链状化合物应为酯,可能为甲酸酯、乙酸酯和丙烯酸酯,若为甲酸酯有3种、若为乙酸酯有1种、若为丙烯酸酯有1种,共有5种,故答案为:3:2:1;5;
(5)结合题给信息,由逆推法可知丙烯生成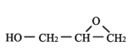 的合成步骤为:丙烯(CH3CH=CH2)与氯气发生加成反应生成
的合成步骤为:丙烯(CH3CH=CH2)与氯气发生加成反应生成![]() ,
,![]() 在氢氧化钠醇溶液中发生消去反应生成
在氢氧化钠醇溶液中发生消去反应生成![]() ,
,![]() 在氢氧化钠溶液中加热发生水解反应生成
在氢氧化钠溶液中加热发生水解反应生成![]() ,
,![]() 在Ag作催化剂的条件下与O2反应生成
在Ag作催化剂的条件下与O2反应生成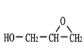 ,合成路线为:
,合成路线为: ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。回答下列问题:
(1)已知:2NO2(g)= N2O4(g) △H=-55.3kJ/mol
N2O5(g)=2NO2(g)+![]() O2(g) △H=+53.1 kJ/mol
O2(g) △H=+53.1 kJ/mol
则:N2O5(g)=N2O4(g)+![]() O2(g) △H=___________ kJ/mol
O2(g) △H=___________ kJ/mol
(2)以乙烯(C2H4)作为还原剂脱硝(NO),脱硝机理如图1。若反应中n(NO)︰n(O2)=2︰1,则总反应的化学方程式为___________;脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2,为达到最佳脱硝效果,应采用的条件是___________。

(3)T1温度时在容积为2L的恒容密闭容器中发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
2NO2(g) △H<0。实验测得:υ正=υ(NO)消耗=2υ(O2)消耗=k正c2(NO)·c(O2),υ逆=(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:

①从0~2s内该反应的平均速率υ(NO)=___________mol/(L·s)。
②T1温度时化学平衡常数K=___________ L/mol。 (结果保留3位有效数字)。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T2___________T1(填“>”、“<”或“=")。
④已知2NO(g)+O2(g)![]() 2NO2的反应历程为:
2NO2的反应历程为:
第一步NO+NO![]() N2O2 快速反应 第二步N2O2+O2→2NO2 慢反应
N2O2 快速反应 第二步N2O2+O2→2NO2 慢反应
下列叙述正确的是___________(填标号)。
A. υ(第一步的正反应)< υ(第二步的反应) B.总反应快慢由第二步决定
C.第二步的活化能比第一步的高 D.第二步中N2O2与O2的碰撞100%有效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乙酸、葡萄糖都可用通式Cn(H2O)m表示其组成,所以乙酸也属于糖类
B.凡是能溶于水且具有甜味的化合物都属于糖类
C.蔗糖能发生银镜反应
D.葡萄糖分子中含有醛基,它具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。

(1)KCl中K+检验时,透过蓝色钴玻璃观察焰色为:___________。
(2) 若用硝酸钡来代替氯化钡,请判断是否可行:______(填“是”或“否”),并说明理由:________。
(3)在过滤后的滤液中通入过量氯气即可将滤液中的KBr杂质除去,发生的反应为:2KBr + Cl2 = 2KCl + Br2,如果按是否有元素的化合价发生了变化来分类,该反应属于_______________反应。
(4) 某同学认为该实验方案中加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液,他的思路如下。请写出沉淀A的化学式:A:_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的性质随原子序数的递增呈周期性变化的原因是( )
A. 元素原子的核外电子排布呈周期性变化 B. 元素原子的电子层数呈周期性变化
C. 元素的化合价呈周期性变化 D. 元素原子半径呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,可依次通过盛有下列哪一组试剂的洗气瓶( )
A.澄清石灰水、浓H2SO4
B.酸性KMnO4溶液、浓H2SO4
C.溴水、浓H2SO4
D.浓H2SO4、NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
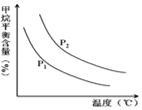
①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
铜、镓、砷等元素形成的化合物在现代工业中有广泛的用途,回答下列问题:
(1)基态铜原子的核外电子占有的能级数为________,轨道数为________。
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为________,其中As的杂化轨道类型为________。
(4)铜与CN-可形成络合离子[Cu(CN-)4]2-,写出一种与CN-等电子体的分子化学式________;若将[Cn(CN-)4]2-中二个CN-换为Cl-,只有一种结构,则[Cu(CN-)4]2-中4个氮原子所处空间位置关系为________。
(5)GaAs的熔点为1238C,密度为p g·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中各元素的数据代表该元素占原子总量的百分比,请据表回答问题:

(1)组成人体的化学元素在元素周期表上都有,它普遍存在于非生物界,生物体内不包含特殊的“生命元素”,这个事实说明_________。
(2)生物从非生物环境中获得的那些元素与环境中的这些元素的比例相差甚远。如岩石圈中,氢。碳。氮加在一起占总原子数不到1%,而在生物体中占总原子数的74%左右。这个事实说明_____________________。
(3)从此表看,人体成分中没有铁的含量,是否人体不含铁?___________。为什么?________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com