
【题目】亚氯酸钠![]() 是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出
是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出![]() ,
,![]() 有类似
有类似![]() 的性质。某兴趣小组探究亚氯酸钠的制备与性质。
的性质。某兴趣小组探究亚氯酸钠的制备与性质。
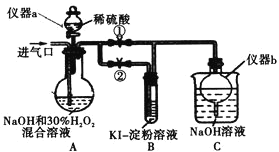
(I)制备亚氯酸钠
关闭止水夹![]() ,打开止水夹
,打开止水夹![]() ,从进气口通入足量
,从进气口通入足量![]() ,充分反应。
,充分反应。
(1)仪器a的名称为_________,仪器b的作用是_________。
(2)装置A中生成![]() 的化学方程式为_________。
的化学方程式为_________。
(3)若从装置A反应后的溶液中获得![]() 晶体,则主要操作有:减压蒸发浓缩、________、过滤、洗涤、干燥等。
晶体,则主要操作有:减压蒸发浓缩、________、过滤、洗涤、干燥等。
(II)探究亚氯酸钠的性质
停止通![]() 气体,再通入空气一段时间后,关闭止水夹
气体,再通入空气一段时间后,关闭止水夹![]() ,打开止水夹
,打开止水夹![]() ,向A中滴入稀硫酸。
,向A中滴入稀硫酸。
(4)请写出这时A中发生反应的离子方程式_________。
(5)开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因_________。
(6)B中现象为_________。
【答案】分液漏斗 防止倒吸 ![]() 降温结晶
降温结晶![]() 或冷却结晶
或冷却结晶![]()
![]()
![]() 与
与![]() 反应生成的
反应生成的![]() 对反应起催化作用 溶液变蓝色
对反应起催化作用 溶液变蓝色
【解析】
![]() 根据装置图判断仪器a的名称;仪器b是球形干燥管,可以防止发生倒吸;
根据装置图判断仪器a的名称;仪器b是球形干燥管,可以防止发生倒吸;
![]() 二氧化氯在碱性溶液中与过氧化氢反应生成亚氯酸钠、水和氧气;
二氧化氯在碱性溶液中与过氧化氢反应生成亚氯酸钠、水和氧气;
![]() 根据从溶液中获得晶体的基本操作回答;
根据从溶液中获得晶体的基本操作回答;
![]() 在酸性条件下生成NaCl并放出ClO
在酸性条件下生成NaCl并放出ClO![]() 气体;
气体;
![]() 根据影响反应速率的因素分析;
根据影响反应速率的因素分析;
![]() 有类似
有类似![]() 的性质,所以在B装置中
的性质,所以在B装置中![]() 与KI发生反应生成碘单质。
与KI发生反应生成碘单质。
![]() 由仪器a的结构可知名称为分液漏斗;ClO
由仪器a的结构可知名称为分液漏斗;ClO![]() 有类似Cl
有类似Cl![]() 的性质,能与氢氧化钠溶液发生反应,仪器b的作用是防止发生倒吸;
的性质,能与氢氧化钠溶液发生反应,仪器b的作用是防止发生倒吸;
![]() 二氧化氯在碱性溶液中与过氧化氢反应生成亚氯酸钠、水和氧气,反应方程式为:
二氧化氯在碱性溶液中与过氧化氢反应生成亚氯酸钠、水和氧气,反应方程式为:![]() ;
;
![]() 从溶液中获得
从溶液中获得![]() 晶体,主要操作有减压蒸发浓缩、降温结晶
晶体,主要操作有减压蒸发浓缩、降温结晶![]() 或冷却结晶
或冷却结晶![]() 、过滤、洗涤、干燥等;
、过滤、洗涤、干燥等;
![]() 在酸性条件下生成NaCl并放出ClO
在酸性条件下生成NaCl并放出ClO![]() , A中发生反应的离子方程式为:
, A中发生反应的离子方程式为:![]() ;
;
![]() 开始时A中反应缓慢,稍后产生气体的速率急剧加快,可推知反应产生了催化剂,应为生成的
开始时A中反应缓慢,稍后产生气体的速率急剧加快,可推知反应产生了催化剂,应为生成的![]() 对反应起催化作用;
对反应起催化作用;
![]() 有类似
有类似![]() 的性质,所以在B装置中
的性质,所以在B装置中![]() 与KI发生反应生成碘单质,溶液变蓝色。
与KI发生反应生成碘单质,溶液变蓝色。


科目:高中化学 来源: 题型:
【题目】有关下图装置中的叙述正确的是( )
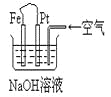
A.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH-
B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2 沉淀的颜色
C.这是电解NaOH溶液的装置
D.Fe为阳极,其电极反应为:Fe-2e-+2OH-=2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如图:
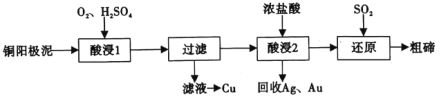
已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为___。
(2)“酸浸1”过程中,为加快浸出速率,可采取的方法有___(填1种)。“酸浸2”时温度过高会使Te的浸出率降低,原因是___。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为___;“还原”过程中,发生反应的离子方程式为___。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为___。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是___。
(5)常温下,向lmol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=___。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,体积相同、浓度均为1.0 mol·L–1的HX溶液、HY溶液,分别加水稀释,稀释后溶液的pH随稀释倍数的对数的变化如图所示,下列叙述正确的是( )
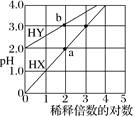
A.HX是强酸,溶液每稀释10倍,pH始终增大1
B.常温下HY的电离常数约为1.0×10–4
C.溶液中水的电离程度:a点大于b点
D.消耗同浓度的NaOH溶液体积:a点大于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是一种二元弱酸,对于0.1mol·L1的过氧化氢溶液,下列叙述不正确的是()
A.H2O2的电离方程式可写作H2O2![]() H++HO2-,HO2-
H++HO2-,HO2-![]() H++O22-
H++O22-
B.加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大
C.加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动
D.加入少量氯化铁溶液,溶液中产生大量气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用钛白渣[主要成分为FeSO4,还含有少量Fe2(SO4)3、MgSO4及TiOSO4]为主要原料生产氧化铁黄(FeOOH)的一种工艺流程如下:
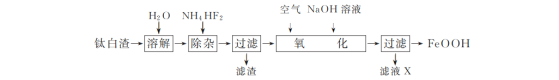
(1)“溶解”时,TiOSO4发生水解生成难溶于水的H2TiO3,反应的化学方程式为________。
(2)“除杂”时,加入NH4HF2固体的作用是________。
(3)“氧化”时,Fe2+生成FeOOH的离子方程式是________。
(4)滤液X中主要含有的阳离子是________(填化学式)。
(5)实验测得反应溶液的pH、温度对氧化铁黄产率的影响如图所示。

①反应温度宜选择________。
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致氧化铁黄产率较低,其可能原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。下列说法中不正确的是
A.D溶液的pH=7
B.四种溶液相比,C溶液中水的电离程度最小
C.A与C等体积混合后,溶液中有c(Cl)>c(H+)>c(NH4+)>c(OH)
D.B与D等体积混合后,溶液中有c(OH)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的盐酸;③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是
A.①和②混合溶液中:c(H+)=3.0 mol·L-1
B.①和④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
C.②和③混合溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
D.四种溶液稀释100倍,溶液的pH:③>④>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是

A.汽车尾气的主要污染成分包括CO和NO
B.NO2是该过程的中间产物
C.NO和O2必须在催化剂表面才能反应
D.该催化转化的总反应方程式为:2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com