
【题目】氮的化合物在生产、生活中广泛存在
(1)键能是气态原子形成1mol化学键释放的最低能量。已知下列化学键的键能如表所示,写出1mol气态肼(NH2-NH2)燃烧生成氮气和水蒸气的热化学方程式_________
化学键 | N≡N | O=O | N-N | N-H | O-H |
键能/(kJ/mol) | 946 | 497 | 193 | 391 | 463 |
(2)用焦炭还原NO的反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
该反应为_____________(填“放热”或“吸热”)反应乙容器中的反应在60min时达到平衡状态,则0-60min内用NO的浓度变化表示的平均反应速率V(NO)=_________
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
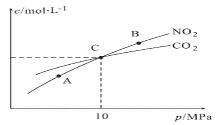
①A、B两点的浓度平衡常数关系:Kc(A)_____________Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是_____________(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=____________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH= -544 kJ·mol-1 放热 0.01mol·L-1·min-1 = A 2Mpa
【解析】
(1)先根据题干信息写出化学反应方程式,然后根据焓变=反应物键能之和-生成物键能之和计算该反应的焓变,然后书写出热化学方程式;
(2)根据比较甲、丙容器中的数据,丙容器中先达到平衡,则说明丙容器中温度高,平衡时丙容器中NO的物质的量高于甲容器,说明温度升高平衡向逆方向移动,从而分析出该反应的热效应;根据2NO(g)+C(s)![]() N2(g)+CO2(g),前后气体体积不变,相同温度下,甲与乙为等效平衡,故乙平衡时NO的物质的量为甲平衡时的一半,即为0.4mol,根据
N2(g)+CO2(g),前后气体体积不变,相同温度下,甲与乙为等效平衡,故乙平衡时NO的物质的量为甲平衡时的一半,即为0.4mol,根据![]() 计算出060min内NO的平均反应速率;
计算出060min内NO的平均反应速率;
(3)①平衡常数只与温度有关,温度不变化学平衡常数不变;
②2NO2(g)+2C(s)![]() N2(g)+2CO2(g),增大压强平衡逆向移动,二氧化氮转化率减小;
N2(g)+2CO2(g),增大压强平衡逆向移动,二氧化氮转化率减小;
③设生成二氧化碳2xmol,列三段式:
2NO2(g)+2C(s)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(mol) 1 0 0
转化(mol) 2x x 2x
平衡(mol)1-2x x 2x
C点时NO2和CO2浓度相等,则1-2x=2x,解得:x=0.25,然后根据Kp的定义求解。
(1)1mol肼(NH2-NH2)燃烧生成氮气和水蒸气的化学反应方程式为:N2H4+O2=N2+2H2O,反应物总键能之和=(4×391+193+497)kJ/mol =2254 kJ/mol,生成物总键能之和=(946+4×463)kJ/mol =2798 kJ/mol,该反应反应热=反应物总键能之和-生成物总键能之和=2254 kJ/mol-2798 kJ/mol=-544 kJ/mol,故1mol气态肼(NH2-NH2)燃烧生成氮气和水蒸气的热化学反应方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH= -544 kJ·mol-1;
(2)根据比较甲容器和丙容器中的数据,丙容器中先达到平衡,则说明丙容器中温度高,平衡时丙容器中NO的物质的量高于甲容器,说明温度升高平衡向逆方向移动,所以该反应是放热反应;
②根据2NO(g)+C(s)![]() N2(g)+CO2(g),前后气体体积不变,相同温度下,甲与乙为等效平衡,故乙平衡时NO的物质的量为甲平衡时的一半,即为0.4mol,则0200min内用NO的浓度变化表示的平均反应速率v(NO)=
N2(g)+CO2(g),前后气体体积不变,相同温度下,甲与乙为等效平衡,故乙平衡时NO的物质的量为甲平衡时的一半,即为0.4mol,则0200min内用NO的浓度变化表示的平均反应速率v(NO)=![]() =
= =0.01mol·L-1·min-1
=0.01mol·L-1·min-1
(3)①A、B两点的温度相同,平衡常数只与温度有关,故浓度平衡常数关系:Kc(A)=Kc(B);
②2NO2(g)+2C(s)![]() N2(g)+2CO2(g),增大压强平衡逆向移动,故A、B、C三点中NO2的转化率最高的是A点;
N2(g)+2CO2(g),增大压强平衡逆向移动,故A、B、C三点中NO2的转化率最高的是A点;
③设生成二氧化碳2xmol,列三段式:
2NO2(g)+2C(s)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(mol)
转化(mol) 2x x 2x
平衡(mol)1-2x x 2x
C点时NO2和CO2浓度相等,则1-2x=2x,解得:x=0.25,因C点时NO2和CO2浓度相等,则NO2和CO2的分压也相等,即Kp(NO2)=Kp(CO2)=![]() ,Kp(N2)=
,Kp(N2)=![]() ,Kp(C)=
,Kp(C)=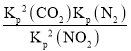 =2MPa。
=2MPa。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】对已经达到平衡的下列体系,只改变一个条件,对平衡移动的方向判断错误的是
A.CaCO3(s) ![]() CaO(s) +CO2(g),减小CO2浓度,平衡正反应方向移动
CaO(s) +CO2(g),减小CO2浓度,平衡正反应方向移动
B.4NH3(g) +5O2(g) ![]() 4NO(g) +6H2O(g):增大压强,平衡向逆反应方向移动
4NO(g) +6H2O(g):增大压强,平衡向逆反应方向移动
C.HS- + H2O ![]() H3O + S2- ,加水稀释,平衡向逆反应方向移动
H3O + S2- ,加水稀释,平衡向逆反应方向移动
D.H2(g) + I2(g) ![]() 2HI(g) :扩大容器体积,平衡不移动
2HI(g) :扩大容器体积,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下物质:
①明矾 ②一水合氨 ③碳酸氢钠 ④硫酸铁 ⑤硝酸钡 ⑥硝酸
请完成下列问题:
(1)属于弱电解质的是___________________;(选填编号)
(2)由于促进水的电离平衡而使溶液显酸性的是__________________;(选填编号)
(3)它们水溶液PH >7的有_________________;(选填编号)
(4)写出下列物质之间发生反应的离子方程式:
①+⑤__________________ ②+④___________________ ③+⑥__________________
(5)明矾溶于水后能净水,是由于Al3+水解后能形成Al(OH)3胶体,该胶体具有吸附性,请写出Al3+水解的方程式:____________________;
硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3ySO3zH2O),为测定某碱式硫酸铁的组成,取5.130g样品溶于足量盐酸中,然后加入过量的BaCl2溶液,经过滤、洗涤、干燥得白色固体5.825g,向上述滤液中加入过量的NaOH溶液,经过滤、洗涤、灼烧得到固体1.600g,该样品的化学式中x、y、z的值分别为_______________(填整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是______________。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是_________、_________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是____________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如表所示:
氧化物 | Li2O | MgO | P4O6 | SO2 |
熔点/°C | 1570 | 2800 | 23.8 | 75.5 |
解释MgO熔点比P4O6熔点高得多的原因______________
(4)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)
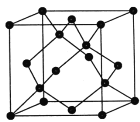
①碳化硅晶体(金刚砂)的化学式______________
②金刚石、晶体硅、碳化硅的熔点由高到低的顺序为__________________
③立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是_____________g/cm3(列出式子并化简,阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一包由Cu、![]() 和CuO组成的混合物均分成两份:一份混合物在加热条件下与
和CuO组成的混合物均分成两份:一份混合物在加热条件下与![]() 充分反应,将固体全部转化成铜粉时固体质量减少了
充分反应,将固体全部转化成铜粉时固体质量减少了![]() ;向另一份混合物中加入
;向另一份混合物中加入![]() 溶液恰好完全反应生成
溶液恰好完全反应生成![]() 和
和![]() 假设不产生其他还原产物
假设不产生其他还原产物![]() ,这些NO和
,这些NO和![]() 标准状况
标准状况![]() 混合并通入足量水中,气体全部被吸收生成
混合并通入足量水中,气体全部被吸收生成![]() 。则该硝酸的物质的量浓度为
。则该硝酸的物质的量浓度为![]()
![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是一种常见化学电源,其原理反应:2H2+O2=2H2O,其工作示意图如图。下列说法不正确的是( )
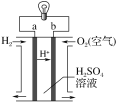
A.a极是负极,发生反应为H2-2e-=2H+
B.b电极上发生还原反应,电极反应式为O2+4H++4e-=2H2O
C.电解质溶液中H+向正极移动
D.放电前后电解质溶液的pH不会发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+可以写成H3O+,从某些性质看,NH3和H2O,![]() 和H3O+,OH-和
和H3O+,OH-和![]() ,N3-和O2-两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
,N3-和O2-两两相似,据此判断下列反应式(反应条件忽略)正确的是( )
①2Na+2NH3=2NaNH2+H2↑
②CaO+2NH4Cl=CaCl2+2NH3↑+H2O
③3Mg(NH2)2=Mg3N2+4NH3↑
④NH4Cl+NaNH2=NaCl+2NH3↑
A.①B.②④C.全部D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)并进行相关实验,电解一段时间后,各部分装置及对应的现象如下:

对应现象 | (1)中黑色固体变红 | (2)电极a附近溶液出现浑浊 | (3)中溶液出现浑浊 | (4)中溶液红色褪去 |
下列对实验现象解释不正确的是( )
A.(1)中:CuO+H2![]() Cu+H2O
Cu+H2O
B.(2)中a电极:2H2O+2e-=H2↑+2OH-,Mg2++2OH-=Mg(OH)2↓
C.(3)中:Cl2+S2-=S↓+2Cl-
D.(4)中:Cl2+H2O![]() HCl + HClO
HCl + HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com