
【题目】某溶液中由水电离出来的c(OH﹣)=10﹣12mol/L,则该溶液中的溶质不可能是( )
A.HCl
B.NaOH
C.NH4Cl
D.H2SO4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、电解质和非电解质的正确组合是
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 天然气 | 硫酸 | 干冰 |
B | 氢氧化钡 | 蔗糖溶液 | 碱石灰 | 三氧化硫 |
C | 胆矾 | 石灰水 | 苛性钾 | 氨气 |
D | 硫酸 | 铝合金 | 氯化钠 | 氢气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】串联电路中四个电解池分别装有0.5molL﹣1的下列溶液,用惰性电极电解,连接直流电源一段时间后,溶液pH最大的是( )
A.KNO3溶液
B.NaCl溶液
C.AgNO3溶液
D.CuCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得101kPa时,1mol H2(g)完全燃烧生成液态水,放出285.8kJ的热量;1mol CH4(g)完全燃烧生成液态水和CO2气体,放出890.3kJ的热量.下列热化学方程式书写正确的是( )
A.2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJ/mol
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890.3 kJ/mol
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3 kJ/mol
D.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上生产硝酸的主要过程中:
(1)反应N2(g)+3H2(g)2NH3(g)△H<0;恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡,图1图象能正确表示该过程中相关量的变化的是 . (选填字母). 
(2)一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ![]() ,则N2的转化率a1=;若向该容器中再加入1molN2和3molH2 , 达到平衡状态时,N2的转化率为a2 , 则a2a1(填“>”、“<”或“=”).
,则N2的转化率a1=;若向该容器中再加入1molN2和3molH2 , 达到平衡状态时,N2的转化率为a2 , 则a2a1(填“>”、“<”或“=”).
(3)2NO(g)+O2(g)2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图2). ①比较P1、P2的大小关系:P1P2(填“>”、“<”或“=”).
②随温度升高,该反应平衡常数变化的趋势是 .
(4)硝酸厂常用如下2种方法处理尾气. ①催化还原法:催化剂存在时用H2将NO2还原为N2 .
已知:2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol
N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 .
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2 . 若每4.6gNO2和Na2CO3溶液反应时转移电子数为0.05mol,则反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色溶液中的离子组可以大量共存的是( )
A. K+、Na+、CO32-、SO42- B. K+、Cu2+、Cl-、SO42-
C. Ba2+、H+、NO3-、SO42- D. H+、Ca2+、ClO-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应SO2(g)+ ![]() O2(g)SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)2SO2(g)+O2(g)的平衡常数K2的值为( )
O2(g)SO3(g)的平衡常数K1=50,在同一温度下,反应2SO3(g)2SO2(g)+O2(g)的平衡常数K2的值为( )
A.2500
B.100
C.4×10﹣4
D.2×10﹣2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、NO2能形成酸雨,某同学以它们为主题设计了两组实验:
【实验一】用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中.分别缓慢通入适量O2或Cl2,如图A、B、C所示。一段时间后,A、B装置的集气瓶中充满溶液(假设瓶内液体不扩散),C装置的集气瓶中还有气体剩余(可考虑液体的扩散) 。
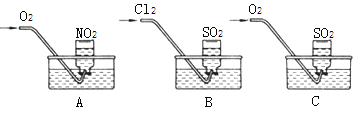
(1)写出装置A中总反应的化学方程式________________,假设该实验条件下,气体摩尔体积为a L/mol,则装置A的集气瓶中所得溶液溶质的物质的量浓度为______。
(2)写出B装置的溶液充满集气瓶时,有关反应的离子方程式__________________。
(3)实验前在C装置的水槽里滴加几滴紫色石蕊试液,通入氧气后,可观察到的实验现象是溶液颜色加深,写出反应的总化学方程式___________________________。
【实验二】利用上图B的原理,设计下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计用于准确测量通过的尾气体积。将尾气通入一定体积的碘水,并通过实验测定SO2的含量。当洗气瓶D中溶液蓝色刚好消失时,立即关闭活塞K。
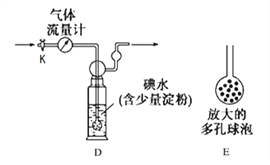
(4)D中导管末端连接一个多孔球泡E,其作用是________,可以提高实验的准确度。
(5)当流量计中刚好通过2L尾气时,D中溶液蓝色刚好消失,立即关闭活塞K,容器D中恰好得到100mL溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g 白色沉淀,通过计算可知,上述尾气中二氧化硫的含量为________g/L。若洗气瓶D中溶液蓝色消失后,没有及时关闭活塞K,测得的SO2含量________(填“偏高”、“偏低”或“无影响”)。
(6)硫的氢化物H2S气体燃烧也可能产生污染物SO2,试计算:标准状况下,0.35molH2S和11.2LO2在点燃条件下充分反应,所得氧化产物总质量为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com