
分析 标准状况下,2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1,若在标准状况下H2和O2组成的混合气体点燃,爆炸后再恢复到标准状况,生成液态水18克即1mol来计算反应放出的热量多;
0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出660KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出$\frac{660}{0.3}$=2200KJ的热量,根据盖斯定律写出其热化学反应方程式,后根据物质的物质的量与反应放出的热量成正比来解答.
解答 解:根据热化学方程式2H2(g)+O2(g)═2H2O(l);△H=-572kJ•mol-1的含义,2mol氢气燃烧生成2mol液态水放出的热量是572kJ,所以生成液态水18克即1mol放出的热量是286kJ,
0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出660KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出$\frac{660}{0.3}$=2200KJ的热量,反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2200kJ/mol,
①B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2200kJ/mol,
②H2O(l)→H2O(g);△H=+44kJ/moL,
由盖斯定律可知①+②×3得:B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2200+44×3=2068kJ/mol,
2.24L(标准状况)即0.1mol乙硼烷完全燃烧生成气态水时放出的热量是2068kJ×0.1=206.8KJ,
故答案为:286;B2H6(g)+3O2(g)=B2O3(s)+3H2O(l)△H=-2200 kJ/mol;206.8.
点评 本题考查燃烧热的热化学方程式的书写、焓变求算,题目难度较大,注意表示热化学方程式的书写要注明物质聚集状态和反应热的正负号问题.


科目:高中化学 来源: 题型:选择题
| A. | 恒温下压缩体积,容器中气体的平均相对分子质量减少 | |
| B. | 再加入一定量氨基甲酸铵,平衡正向移动 | |
| C. | CO2的体积分数不变则该反应达到平衡状态 | |
| D. | 25℃时氨基甲酸铵的分解平衡常数为2.048×10-9mol3•L-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检测时,电解质溶液中的H+向正极移动 | |
| B. | 若溶液中有0.4 mol电子通过,则在标准状况下消耗4.48L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为:O2+4e-+4H+═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 目前工业合成氨的原理是:
目前工业合成氨的原理是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15% | B. | 10.05% | C. | 9.5% | D. | 5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
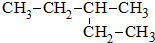
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com