
分析 结合化学平衡三段式列式计算,根据n=cV计算生成Q的物质的量,结合R的物质的量,利用物质的量之比等于化学计量数之比计算x的值;
(1)依据反应速率V=$\frac{△c}{△t}$计算得到;
(2)根据C可知参加反应N的物质的量,N的转化率=$\frac{参加反应的N的物质的量}{N的起始物质的量}$×100%;
(3)平衡时气体Q所占的体积分数,可以利用气体物质的量分数计算;
(4)根据物质的量之比等于化学计量数之比计算x的值.
解答 解:经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L,Q物质的量=0.4mol/L×2L=0.8mol,物质的量之比等于化学计量数之比,0.8:2.4=x:3,计算得到x=1;
2M(g)+3N(g)?Q(g)+3R(g)
起始量(mol) 2 3 0 0
变化量(mol) 1.6 2.4 0.8 2.4
平衡量(mol) 0.4 0.6 0.8 2.4
(1)用气体M来表示该反应的化学反应速率=$\frac{\frac{1.6mol}{2L}}{2min}$=0.4mol/L,
答:用气体M来表示该反应的化学反应速率0.4mol/L;
(2)N的转化率=$\frac{2.4mol}{3mol}$×100%=80%,
答:N的转化率80%;
(3)平衡时气体Q所占的体积分数=气体物质的量分数=$\frac{0.8mol}{0.4mol+0.6mol+0.8mol+2.4mol}$×100%=19%;
答:平衡时气体Q所占的体积分数19%;
(4)经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L,Q物质的量=0.4mol/L×2L=0.8mol,物质的量之比等于化学计量数之比,0.8:2.4=x:3,计算得到x=1,
答:x等于1.
点评 本题考查了化学平衡计算分析应用,主要是气体体积分数,转化率,压强之比等的计算应用,掌握基础是关键,题目较简单.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 全错 | B. | 只有④正确 | C. | ①③④正确 | D. | ①②③正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 石灰乳与稀盐酸反应:H++OH-═H2O | |
| C. | 氢氧化镁溶于盐酸:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH3的质量为17 g•mol-1 | |
| B. | H2SO4的摩尔质量为98g | |
| C. | 3.01×1023个O3分子和 3.01×1023个O2分子电子数之比等于1:1 | |
| D. | 等物质的量的CO2分子和CO分子的质量比等于11:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
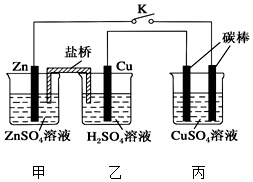 用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )| A. | 乙烧杯中铜棒为正极,其电极反应式为2H++2e-═H2↑ | |
| B. | 丙烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应时盐桥中的阴离子向甲烧杯移动 | |
| D. | 导线中通过电子的物质的量为0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
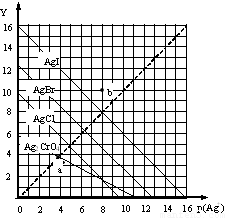 卤化银AgX的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标Y=-lgc(X-).下列说法正确的是( )
卤化银AgX的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标Y=-lgc(X-).下列说法正确的是( )| A. | 该温度下AgCl的Ksp约为1×10-15 | |
| B. | a点时c(Ag+)=c(I-),AgI处于平衡状态 | |
| C. | b点可表示AgBr的不饱和溶液 | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知25℃时KSP(PbSO4)=1.6×10-8、KSP(BaSO4)=1.1×10-10,该温度下PbSO4在不同浓度的硫酸中的溶解度如图所示.下列有关说法不正确的是( )
已知25℃时KSP(PbSO4)=1.6×10-8、KSP(BaSO4)=1.1×10-10,该温度下PbSO4在不同浓度的硫酸中的溶解度如图所示.下列有关说法不正确的是( )| A. | 图中A点c(SO42-)=7mol•L-1 | |
| B. | 过滤的PbSO4沉淀,用稀硫酸洗涤,可以减少沉淀损耗 | |
| C. | 硫酸浓度大于5mol•L-1时,PbSO4溶解度增大的原因是转化成Pb(HSO4)2 | |
| D. | 将Pb(NO3)2、Ba(NO3)2混合溶液滴入稀硫酸中,能生成PbSO4和BaSO4两种沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用惰性电极电解1L1mol•L-1的CuSO4溶液,当阴极析出3.2g铜时,加入0.05molCu(OH)2固体可将溶液恢复至原浓度 | |
| B. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H>0 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 | |
| D. | 25℃时,向0.1 mol•L-1 CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com