
| A. | +172.22 kJ•mol-1 | B. | -172.22 kJ•mol-1 | ||
| C. | +392.92 kJ•mol-1 | D. | -392.92 kJ•mol-1 |
分析 根据盖斯定律构造出目标反应热化学反应方程式,据此计算反应热;注意化学计量数乘以不同的系数,进行加减,焓变也要乘以相同的系数,做相应加减.
解答 解:①C(s)+$\frac{1}{2}$O2(g)=CO(g)△H1=-110.35kJ/mol,②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=-282.57kJ/mol,根据盖斯定律,①+②得:C(s)+O2(g)=CO2(g),△H=-110.35kJ/mol+(-282.57kJ/mol)=-392.92kJ/mol,
故选D.
点评 本题考查了盖斯定律的计算应用,注意热化学方程式系数变化焓变随之变化,反应改变方向,焓变改变符号,题目较简单.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:填空题
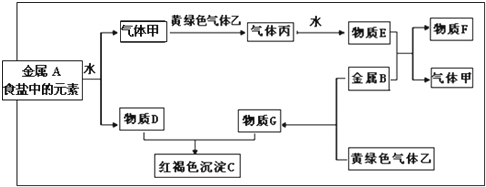
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3用量为25.0mL,大理石用量为10.00g.| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格 (粗、细)对该反应速率 的影响. |
| ② | ||||
| ③ | ||||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在某淀粉溶液中加入适量的稀硫酸,并加热一段时间,待冷却后,再加入银氨溶液来检验淀粉是否已发生水解 | |
| B. | 把R-X与NaOH水溶液混合,加入硝酸银溶液来验证R-X是否为碘代烷 | |
| C. | 在三颈烧瓶中先加入少量铁粉,再加入5mL苯和1mL液溴的混合物,待充分反应后可制得少量溴苯 | |
| D. | 将无水乙醇和浓硫酸共热至140℃可制得乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | 只有③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两烧杯中的沉淀可能一样多 | |
| B. | 两烧杯中沉淀的最大可能值均为0.078g | |
| C. | 反应后两烧杯中溶液的pH可能:甲<乙 | |
| D. | 两烧杯中反应的离子方程式不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A. | 能使酸性KMnO4溶液褪色 | B. | 能使溴水褪色 | ||
| C. | 在一定条件下可以发生加聚反应 | D. | 一定条件下,能和NaOH醇溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com