
分析 根据n=$\frac{m}{M}$计算物质的量之比,结合分子式计算含有原子数目之比;每个CO2分子含有22个电子,电子物质的量为二氧化碳的22倍,每个CO分子含有14个电子,电子物质的量为CO的14倍;同温同压下,气体的密度之比等于其摩尔质量之比.
解答 解:根据n=$\frac{m}{M}$可知,等质量的CO2和CO的物质的量之比为28g/mol:44g/mol=7:11,含有原子数目之比为7×3:11×2=21:22,每个CO2分子含有22个电子,每个CO分子含有14个电子,含有电子数目之比为7×22:11×14=1:1,同温同压下,气体的密度之比等于其摩尔质量之比,CO2和CO的密度之比为44g/mol:28g/mol=11:7,
故答案为:7:11; 21:22; 1:1;11:7.
点评 本题考查阿伏伽德罗定律及其推论、物质的量的计算,比较基础,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

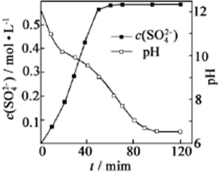
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钠溶液有白色沉淀产生,再加稀硝酸沉淀不消失,一定有Ag+ | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(H2)=0.1 mol•L-1•s-1 | B. | υ(N2)=0.2 mol•L-1•min-1 | ||
| C. | υ(NH3)=0.15 mol•L-1•min-1 | D. | υ(H2)=0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 | |
| B. | 对于物质的量浓度相同的氢氧化钠和氨水,加水稀释至m倍和n倍后,若稀释后溶液的pH相等,则m<n | |
| C. | 在中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用 | |
| D. | 25℃时NH4Cl溶液的Kw大于100℃时NaCl溶液的Kw |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业.利用废气中的 CO2为原料可制取甲醇,在恒容密闭容器中,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业.利用废气中的 CO2为原料可制取甲醇,在恒容密闭容器中,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 精炼铜的阳极泥中可回收金、银等贵金属 | |
| B. | 废旧金属是一种固体废弃物,会污染环境 | |
| C. | 废旧金属的回收利用,即能防止环境污染,又能缓解资源短缺矛盾 | |
| D. | 废旧金属回收利用的成本比从矿石中冶炼出等量的金属成本高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com