

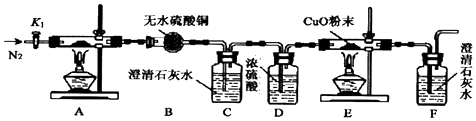
分析 (1)由图可知,A中生成二氧化碳,在C中二氧化碳与碳酸钠、水反应生成碳酸氢钠;
(2)B中酸可抑制二氧化碳的溶解;
(3)配制溶液是计算固体质量,称量、溶解、转移、洗涤转移、定容、摇匀得到溶液,据此选择仪器;
①Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀;
②样液与BaCl2溶液混合,现白色沉淀并有气体产生,沉淀为碳酸钡、气体为二氧化碳;Na2CO3和BaCl2溶液混合也能生成沉淀;
③甲同学:蒸发后冷却,测定pH,可确定固体存在碳酸氢钠,补充实验为对比性实验;
乙同学:A点说明碳酸氢钠分解,残留率为63.09%.
解答 解:(1)由图可知,A中生成二氧化碳,在C中二氧化碳与碳酸钠、水反应生成碳酸氢钠,该反应为Na2CO3+CO2+H2O═2NaHCO3,
故答案为:Na2CO3+CO2+H2O═2NaHCO3;
(2)B中酸可抑制二氧化碳的溶解,则B中溶液的作用为CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体,
故答案为:CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体;
(3)准确称取一定质量的固体,配成1000mL溶液作为样液,其余固体备用,结合步骤分析可知,配制溶液时肯定不需要如图2所示仪器中的A、C,配制上述溶液还需用到的玻璃仪器是搅拌所用玻璃棒,溶解用的烧杯,
故答案为:AC;烧杯、玻璃棒;
①Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,所以无法确定固体的成分中是否含有NaHCO3,
故答案为:Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3;
②样液与BaCl2溶液混合,现白色沉淀并有气体产生,沉淀为碳酸钡、气体为二氧化碳,离子反应为2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O;Na2CO3和BaCl2溶液混合也能生成沉淀,则不能确定是否存在Na2CO3,结论合理,
故答案为:2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O;合理;
③甲同学:取样液400mL,用pH计测溶液pH,再水浴加热蒸发至200mL,接下来的操作是冷却到室温,加水至溶液体积为400mL,再次测定pH,可确定固体存在碳酸氢钠,补充实验为取相同质量的纯净的NaHCO3配成1000mL溶液,取400mL,重复甲的实验,进行对照,
故答案为:冷却到室温,加水至溶液体积为400mL,再次测定pH;取相同质量的纯净的NaHCO3配成1000mL溶液,取400mL,重复甲的实验,进行对照;
乙同学:A点说明碳酸氢钠分解,残留率为63.09%,可知白色固体为碳酸氢钠,
故答案为:白色固体为NaHCO3.
点评 本题考查化学实验方案的评价,涉及物质的性质,盐类水解、化学平衡、差量法计算、图象分析较等,综合性较强,差量的计算方法为解答的难点,题目难度较大.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
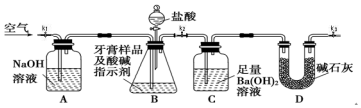
| 实验步骤 | 预期现象与结论 |
| 取适量牙膏样品于试管中,加入足量的NaOH溶液,过滤,向滤液中滴加盐酸. | 滤液中先出现白色沉淀,随后沉淀溶解,说明该牙膏摩擦剂中含氢氧化铝. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| Cl2的体积 (标准状况下)/L | 2.8 | 5.6 | 11.2 |
| n(A-)/mol | 1.25 | 1.5 | 2 |
| n(B-)/mol | 1.5 | 1.4 | 0.9 |
| n(C-)/mol | a | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
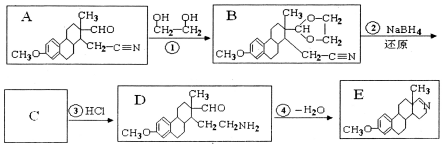
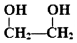 的名称为乙二醇;写出其与对苯二甲酸反应生成高聚物的化学方程式
的名称为乙二醇;写出其与对苯二甲酸反应生成高聚物的化学方程式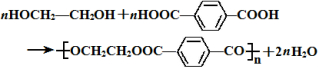 ;
;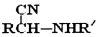 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$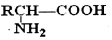
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
 ,G与F分别形成的简单离子半径大小关系为N3->Na+.
,G与F分别形成的简单离子半径大小关系为N3->Na+. 、
、 .
. ;
; ,该化合物与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑..
,该化合物与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑..查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com