
【题目】某课外活动小组对甲酸进行了如下的实验,以验证其含有醛基,并考察其化学性质。首先做了银镜反应:
(1)取少量甲酸加入NaOH溶液中和其酸性,反应的离子方程式为_________________。
(2)在(1)的溶液中加入足量银氨溶液,加热,产生了银镜。甲酸钠溶液与银氨溶液发生银镜反应的离子方程式为_______________________________________________。
(3)某同学很成功的做了银镜反应,他肯定没有进行的操作_________________(写字母):
A.用洁净的试管 B.向银氨溶液中加入硝酸酸化
C.用前几天配制好的银氨溶液 D.直接在银氨溶液里加入稍过量的甲酸;
E.在浓度为2%的NH3H2O中滴入稍过量的浓度为2%的硝酸银
然后,同学们对甲酸与甲醇的酯化反应进行了研究:
(4)写出![]() 和CH3-18OH进行酯化反应的化学方程式______________________。
和CH3-18OH进行酯化反应的化学方程式______________________。
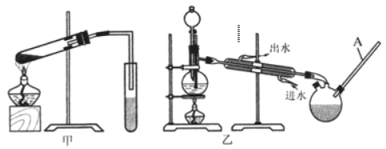
(5)你认为选择甲装置还是乙装置好?_______,原因是______________________。乙装置中长导管C的作用是_________________。
(6)实验中饱和碳酸钠溶液的作用是_____________________________。从饱和碳酸钠溶液中分离出酯需要用到的主要实验仪器是_______________。
(7)一同学用装有饱和氢氧化钠的三颈烧瓶接收甲酸甲酯,几乎没有收集到产物,请给予合理的解释_______________________________。
【答案】NaOH+HCOOH=HCOONa+H2O HCOO-+2Ag(NH3)2++2OH-![]() NH4++CO32-+2Ag↓+3NH3+H2O BCDE HCOOH+CH318OH
NH4++CO32-+2Ag↓+3NH3+H2O BCDE HCOOH+CH318OH![]() HCO18OCH3+H2O 乙 冷凝效果好,减少了甲醇等有毒物质对大气的污染 冷凝回流 除去甲酸,吸收乙醇,减少产物在水中的溶解度 分液漏斗 强碱性条件下,甲酸甲酯水解了
HCO18OCH3+H2O 乙 冷凝效果好,减少了甲醇等有毒物质对大气的污染 冷凝回流 除去甲酸,吸收乙醇,减少产物在水中的溶解度 分液漏斗 强碱性条件下,甲酸甲酯水解了
【解析】
(1)甲酸和氢氧化钠发生酸碱中和反应,生成相应的盐和水;
(2)能发生银镜反应的物质必含有醛基官能团,甲酸含有醛基,可以发生银镜反应;
(3)依据银镜反应的实验操作和注意问题分析判断;
(4)依据酯化反应的反应历程是羧酸脱羟基醇脱氢书写;
(5)根据甲醇性质分析,甲醇是有毒的易挥发的有机物;
(6)根据甲酸、甲醇的性质和饱和碳酸钠的作用解答;
(7)酯在碱溶液中水解生成羧酸盐和醇。
(1)甲酸与氢氧化钠溶液发生酸碱中和反应,生成甲酸钠和水,方程式为:NaOH+HCOOH=HCOONa+H2O;
(2)甲酸含有醛基,能发生银镜反应,发生反应HCOO-+2Ag(NH3)2++2OH-![]() NH4++CO32-+2Ag↓+3NH3+H2O;
NH4++CO32-+2Ag↓+3NH3+H2O;
(3)银镜反应的条件是在碱性条件下发生,在新制的银氨溶液中加入少量需要检验的有机物,水浴加热,生成银镜现象,反应过程中不能振荡,试管要洁净,银氨溶液需要新制,制备方法是想硝酸银溶液中加入氨水,生成沉淀,继续加入到沉淀恰好溶解得到银氨溶液,所以成功的做了银镜反应,
A.用洁净试管使银析出均匀,故A需要;
B.银镜反应需要反应的条件是碱性条件,不需要用硝酸酸化,故B不需要;
C.久置的银氨溶液会析出氮化银、亚氨基化银等爆炸性沉淀物,易发生危险。故C不需要;
D.银镜反应需要反应的条件是碱性条件,甲酸不能过量,故D不需要;
E.在浓度为2%的NH3H2O中滴入稍过量的浓度为2%的硝酸银,滴加试剂顺序错误,需碱过量,故E不需要;
故答案为:BCDE;
(4)甲酸和甲醇进行酯化反应的历程是羧酸脱羟基醇脱氢,反应化学方程式为:HCOOH+CH318OH![]() HCO18OCH3+H2O;
HCO18OCH3+H2O;
(5)甲醇是有毒的易挥发的有机物,需要密封装置中进行,所以选择乙,冷凝效果好,再加之乙装置中长导管C的冷凝回流作用,减少了甲醇等有毒物质对大气的污染;
(6)为了降低甲酸甲酯的溶解度,同时还能除去混有的甲醇和甲酸,需用饱和碳酸钠溶液;甲酸甲酯在饱和碳酸钠溶液中的溶解度极小,分离两种互不相溶的液体,用分液将其分离,分液用到分液漏斗;
(7)用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,是因为甲酸甲酯在NaOH溶液中发生水解,生成甲酸钠和甲醇,得不到酯。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
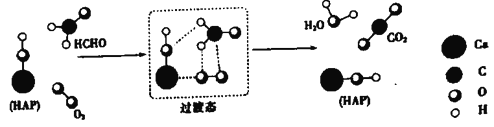
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图中相关信息,判断下列说法不正确的是( )
A.在NaCl晶体中,距离Na+最近的Cl-形成正八面体
B.该气态团簇分子的分子式为E4F4或F4E4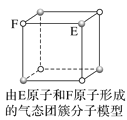
C.锌晶体采取六方最密堆积,配位数为8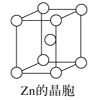
D.KO2晶体中每个K+周围有6个紧邻的O2-,每个O2-周围有6个紧邻的K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是

A.由图甲推断,B点SO2的平衡浓度为0.3 mol·L-1
B.由图甲推断,A点对应温度下该反应的平衡常数为800L·mol-1
C.压强为0.50 MPa时不同温度下SO2转化率与温度关系如乙图,则T2>T1
D.达平衡后,若增大容器容积,则反应速率变化图像可以用图丙表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应![]() 在体积固定的密闭容器中反应,达到平衡状态的标志是( )
在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2,同时生成2nmol![]()
②混合气体的压强不再改变
③混合气体的平均相对分子质量不再改变
④单位时间内生成nmolO2,同时生成2nmolNO
⑤混合气体的颜色不再改变
⑥用![]() 、NO、
、NO、![]() 的物质的量浓度变化表示的反应速率的比为2:2:1
的物质的量浓度变化表示的反应速率的比为2:2:1
A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.升高温度,水的离子积增大
B.![]() 气体受压缩后,气体颜色先加深,后略变浅
气体受压缩后,气体颜色先加深,后略变浅
C.![]() ,
,![]() ,HIg的平衡体系,压缩容器体积,气体色变深
,HIg的平衡体系,压缩容器体积,气体色变深
D.![]() 中加入
中加入![]() 溶液,溶液颜色变浅
溶液,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某 500 mL 溶液中只可能含有 Na+、NH4+、Mg2+、Al3+、Fe2+、Fe3+、Cl-、![]() 、
、![]() 中 的几种离子。
中 的几种离子。
已知:NH4++OH-=NH3↑ +H2O
(1)取该溶液l00 mL,逐滴加入足量的NaOH溶液并加热,生成标准状况下的气体体积为 896 mL(气体已全部逸出),滴加过程中无沉淀生成。则该溶液中一定不含有的阳离子是______.
(2)另取100 mL原溶液于试管中,滴加足量的BaCl2溶液,生成白色沉淀6.27 g,再加入足量稀盐酸,沉淀部分溶解,生成标准状况下的气体体积为448 mL。则原浓液中下列离子的浓度:
离子种类 | 离子浓度 |
| ①___molL-1 |
| ②___ molL-1 |
Na+ | ③__molL-1 |
写出加入盐酸时,生成气体的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为发光二极管连接柠檬电池装置,下列说法正确的是
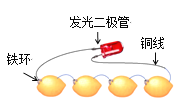
A. 铁环作为柠檬电池的正极
B. 电子由发光二极管经导线流向Fe环
C. 负极的电极反应为:Fe-2 e-===Fe2+
D. 可将柠檬替换成盛装酒精溶液的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH均为3,体积均为![]() 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是![]()
![]()
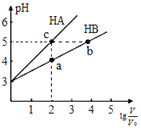
A.水的电离程度:![]()
B.溶液中离子总浓度:![]()
C.稀释相同倍数时:![]()
D.溶液中离子总物质的量:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com