
 SO42-+CaCO3.
SO42-+CaCO3.分析 CaCl2溶液中滴入Na2SO4溶液生成沉淀CaSO4;
CaSO4在水中微溶,溶液中存在难溶电解质的溶解平衡:Ca2++SO42- CaSO4↓,碳酸钙溶解度小于硫酸钙,加入Na2CO3溶液会生成沉淀CaCO3,依据沉淀溶解平衡移动因素解答.
CaSO4↓,碳酸钙溶解度小于硫酸钙,加入Na2CO3溶液会生成沉淀CaCO3,依据沉淀溶解平衡移动因素解答.
解答 解:(1)CaCl2溶液中滴入Na2SO4溶液生成沉淀CaSO4,离子方程式:Ca2++SO42-=CaSO4↓,
故答案为:Ca2++SO42-=CaSO4↓;
(2)CaSO4在水中微溶,溶液中存在难溶电解质的溶解平衡:Ca2++SO42- CaSO4↓,碳酸钙溶解度小于硫酸钙,加入Na2CO3溶液会生成沉淀CaCO3,实现沉淀的转化,所以吸取上层清液置于试管中,滴入1mol•L-1Na2CO3溶液.会看到产生白色沉淀,离子方程式:CaSO4+CO32-
CaSO4↓,碳酸钙溶解度小于硫酸钙,加入Na2CO3溶液会生成沉淀CaCO3,实现沉淀的转化,所以吸取上层清液置于试管中,滴入1mol•L-1Na2CO3溶液.会看到产生白色沉淀,离子方程式:CaSO4+CO32-  SO42-+CaCO3,
SO42-+CaCO3,
故答案为:产生白色沉淀;CaSO4+CO32- SO42-+CaCO3;
SO42-+CaCO3;
(3)通过(1)(2)的实验现象可知:沉淀溶解平衡,溶解度小的容易转化为溶解度更小,故答案为:沉淀溶解平衡,溶解度小的容易转化为溶解度更小.
点评 本题考查了离子方程式的书写、沉淀溶解平衡的影响因素,明确沉淀转化规律是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1:2 | |
| B. | 含X和Z元素的常见化合物为分子晶体 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12种 | B. | 10种 | C. | 8种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 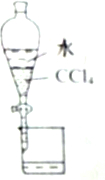 分离CCl4和水 | |
| B. |  洗涤沉淀时,向漏斗中加适量水,搅拌并滤干 | |
| C. |  液体分层,下层呈无色 | |
| D. |  除去氯气中的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol•L-1) | 0.8 | 1.24 | 1.24 |
| A. | 平衡后升高温度,平衡常数>400 | |
| B. | 平衡时,c(CH3OCH3)=1.6 mol•L-1 | |
| C. | 平衡时,反应混合物的总能量减少40 kJ | |
| D. | 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com