
在一个固定体积为2升的密闭容器中,充入2mol A和1mol B,发生如下反应:2A(g)+B(g)⇌3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L.
(1)2分钟内用B表示的平均反应速度为 ;
(2)若容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为: (填“吸热”或“放热”)反应.
考点:
化学平衡的影响因素;反应速率的定量表示方法.
专题:
化学平衡专题.
分析:
2分钟反应达到平衡,此时C的浓度为1.2mol/L,则
2A(g)+B(g)⇌3C(g)+D(s),
开始 1 0.5 0
转化0.8 0.4 1.2
平衡0.2 0.1 1.2
(1)K为生成物浓度幂之积与反应物浓度幂之积的比,结合反应速率与化学计量数之比计算;
(2)温度升高,平衡时混合气体的平均相对摩尔质量减小,D为固体,正向移动,气体质量减小,平衡正向移动.
解答:
解:2分钟反应达到平衡,此时C的浓度为1.2mol/L,则
2A(g)+B(g)⇌3C(g)+D(s),
开始 1 0.5 0
转化 0.8 0.4 1.2
平衡 0.2 0.1 1.2
(1)C的反应速率为 =0.6mol/(L.min),则B的反应速率为0.2mol/(L.min),故答案为:0.2mol/(L.min);
=0.6mol/(L.min),则B的反应速率为0.2mol/(L.min),故答案为:0.2mol/(L.min);
(2)温度升高,平衡时混合气体的平均相对摩尔质量减小,D为固体,正向移动,气体质量减小,平衡正向移动,则正反应为吸热反应,故答案为:吸热.
点评:
本题考查化学平衡的建立、平衡移动等,注意反应速率的关系、温度对平衡的移动即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列关于化学与环境的叙述不正确的是()
A. 航天飞机上的隔离陶瓷属于复合材料
B. CO2和NO2是造成酸雨的主要原因
C. 燃煤中加入适量石灰石,可减少废气中SO2的含量
D. 垃圾是放错地方的资源,应分类回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
国际无机化学命名委员会在1989年曾经建议,把长式周期表原先的主、副族及族号取消,从左到右改为第1~18列,第ⅠA族为第1列,稀有气体元素为第18列.按这个规定,下列说法不正确的是( )
|
| A. | 第15列元素的最高价氧化物为R2O5 |
|
| B. | 第2列元素中肯定没有非金属元素 |
|
| C. | 第17列元素的第一种元素无含氧酸 |
|
| D. | 第16、17列元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 增大压强,活化分子数增加,化学反应速率一定增大 |
|
| B. | 升高温度,活化分子百分数增加,化学反应速率一定增大 |
|
| C. | 活化分子间所发生的分子间的碰撞为有效碰撞 |
|
| D. | 加入反应物,使活化分子百分数增加,化学反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
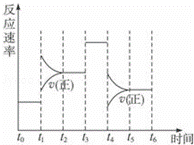
在一密闭体系中发生下列反应A(g)+3B(g)⇌2C(g)△H<0,如图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
(1)t1、t3、t4时刻体系中所改变的条件可能是: 、 、 ;
(2)C体积分数最高的时间段是 .(填“tx﹣ty”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所选装置不合理的是()
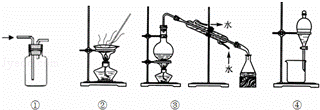
A. 用排空气法收集NH3,选① B. 从食盐水中获得食盐,选②
C. 用自来水制取蒸馏水,选③ D. 用CC14提取碘水中的碘,选④
查看答案和解析>>
科目:高中化学 来源: 题型:
认真观察下列装置,回答下列问题:
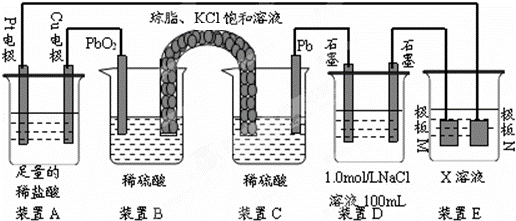
(1)装置B中PbO2上发生的电极反应方程式为 .
(2)装置A中总反应的离子方程式为 .
(3)若装置E中的目的是在Cu材料上镀银,则X为 ,极板N的材料为Ag.若装置E的目的是验证金属的电化学防腐,则极板N的材料为 .
(4)当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为 L(标准状况下).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com