
【题目】某化学兴趣小组利用硫酸铁溶液与铜粉反应,又向反应后溶液中加入KSCN溶液以检验Fe3+是否有剩余,实验记录如下;
实验编号 | 操作 | 现象 |
实验1 |
| i.加入Cu粉后充分振荡,溶液逐渐变蓝; ii.取少量i中清液于试管中,滴加2滴 0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。 |
(1)写出实验1中第i步的离子方程式_______________。甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。查阅相关资料如下
①2Cu2++4SCN- ![]() 2CuSCN↓(白色)+(SCN)2(黄色)
2CuSCN↓(白色)+(SCN)2(黄色)
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
该同学又通过如下实验验证猜想
实验编号 | 操作 | 现象 |
实验2 |
| 溶液呈绿色,一段时间后后开始出现白色沉淀,上层溶液变为黄色 |
实验3 |
| 无色溶液立即变红,同时生成白色沉淀。 |
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是___________________________________________。
(3)根据实验2、3的实验现象,甲同学推断实验3中溶液变红是由于Fe2+被(SCN)2氧化,写出溶液变红的离子方程式_______________________。继续将实验2中的浊液进一步处理,验证了这一结论的可能性。
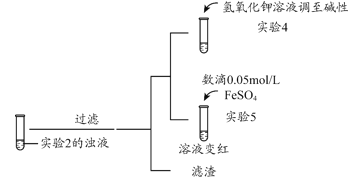
补充实验4的目的是排除了溶液存在Cu2+的可能,对应的现象是____________________________________________。
(4)乙同学同时认为,根据氧化还原反应原理,在此条件下,Cu2+也能氧化Fe2+,他的判断依据是_______。
(5)为排除干扰,小组同学重新设计如下装置。
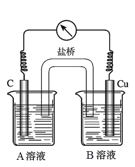
①A溶液为____________________________。
②“电流表指针偏转,说明Cu与Fe3+发生了反应”,你认为这种说法是否合理?__________________(填合理或不合理),原因是__________________________________________。
③验证Fe3+是否参与反应的操作是________________________________________
【答案】Cu+2Fe3+![]() 2Fe2++Cu2+ 部分(SCN)2与水反应生成酸 Fe3++3SCN-
2Fe2++Cu2+ 部分(SCN)2与水反应生成酸 Fe3++3SCN-![]() Fe(SCN)3 溶液褪色,无蓝色沉淀 在Cu2+与SCN-反应中,Cu2+是氧化剂,氧化性Cu2+〉(SCN)2 0.5mol/L的Fe2(SO4)3溶液 不合理 未排除氧气干扰 一段时间后,取少量A溶液于试管中,滴加铁氰化钾溶液,出现蓝色沉淀
Fe(SCN)3 溶液褪色,无蓝色沉淀 在Cu2+与SCN-反应中,Cu2+是氧化剂,氧化性Cu2+〉(SCN)2 0.5mol/L的Fe2(SO4)3溶液 不合理 未排除氧气干扰 一段时间后,取少量A溶液于试管中,滴加铁氰化钾溶液,出现蓝色沉淀
【解析】
(1) Cu粉与Fe3+反应,离子方程式为Cu+2Fe3+![]() 2Fe2++Cu2+;
2Fe2++Cu2+;
(2)硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间,能与水反应,生成酸;
(3) Fe2+被(SCN)2氧化为Fe3+,Fe3+与KSCN反应,显红色;(SCN)2会与氢氧化钾反应,同时Cu2+与氢氧化钾反应,生成蓝色沉淀,没有Cu2+则无蓝色沉淀;
(4)根据氧化还原反应规律分析;
(5)①A的电极为C,B的电极为Cu,则Cu做负极,C做正极,A中放电解质溶液;
②溶液中的氧气会影响反应;
③铁氰化钾溶液遇亚铁盐则生成深蓝色沉淀。
(1) Cu粉与Fe3+反应,离子方程式为Cu+2Fe3+![]() 2Fe2++Cu2+,故答案为:Cu+2Fe3+
2Fe2++Cu2+,故答案为:Cu+2Fe3+![]() 2Fe2++Cu2+;
2Fe2++Cu2+;
(2)硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间,能与水反应,生成酸,故答案为:部分(SCN)2与水反应生成酸;
(3) Fe2+被(SCN)2氧化为Fe3+,Fe3+与KSCN反应,显红色,离子方程式为Fe3++3SCN-![]() Fe(SCN)3;(SCN)2会与氢氧化钾反应,同时Cu2+与氢氧化钾反应,生成蓝色沉淀,没有Cu2+则无蓝色沉淀,故答案为:Fe3++3SCN-
Fe(SCN)3;(SCN)2会与氢氧化钾反应,同时Cu2+与氢氧化钾反应,生成蓝色沉淀,没有Cu2+则无蓝色沉淀,故答案为:Fe3++3SCN-![]() Fe(SCN)3;溶液褪色,无蓝色沉淀;
Fe(SCN)3;溶液褪色,无蓝色沉淀;
(4)根据2Cu2++4SCN- ![]() 2CuSCN↓(白色)+(SCN)2(黄色), Cu2+是氧化剂,氧化性Cu2+>(SCN)2,(SCN)2能氧化Fe2+,则氧化性 (SCN)2 > Fe2+,即Cu2+也能氧化Fe2+,故答案为:在Cu2+与SCN-反应中,Cu2+是氧化剂,氧化性Cu2+>(SCN)2;
2CuSCN↓(白色)+(SCN)2(黄色), Cu2+是氧化剂,氧化性Cu2+>(SCN)2,(SCN)2能氧化Fe2+,则氧化性 (SCN)2 > Fe2+,即Cu2+也能氧化Fe2+,故答案为:在Cu2+与SCN-反应中,Cu2+是氧化剂,氧化性Cu2+>(SCN)2;
(5)①A的电极为C,B的电极为Cu,则Cu做负极,C做正极,A中放电解质溶液,则电解质为0.5mol/L的Fe2(SO4)3溶液,故答案为:0.5mol/L的Fe2(SO4)3溶液;
②溶液中的氧气会影响反应,未做排氧操作,不合理,故答案为:不合理;未排除氧气干扰;
③Fe3+参与反应后生成Fe2+,铁氰化钾溶液遇亚铁盐则生成深蓝色沉淀,可验证产生的Fe2+,操作为一段时间后,取少量A溶液于试管中,滴加铁氰化钾溶液,出现蓝色沉淀,故答案为:一段时间后,取少量A溶液于试管中,滴加铁氰化钾溶液,出现蓝色沉淀。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】室温下,向某Na2CO3和NaHCO3的混合溶液中逐滴加入BaCl2溶液,溶液中lgc(Ba2+)与![]() 的变化关系如图所示。下列说法正确的是( )
的变化关系如图所示。下列说法正确的是( )
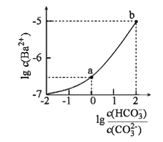
(已知:H2CO3的Ka1、Ka2分别为4.2×10-7、5.6×10-11)
A.a对应溶液的pH小于b
B.b对应溶液的c(H+)=4.2×10-7mol·L-1
C.a→b对应的溶液中![]() 减小
减小
D.a对应的溶液中一定存在:2c(Ba2+)+c(Na+)+c(H+)=3c(HCO3-)+c(Cl-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在相互转化、工业生产等方面应用广泛,回答下列问题。
(1)N2O是一种能刺激神经使人发笑的气体,可发生分解反应2N2O=2N2+O2,碘蒸气能大幅度提高N2O的分解速率,反应历程为:
第一步: I2(g)=2I(g) (快反应)
第二步: I(g)+N2O(g)=N2(g)+IO(g) (慢反应)
第三步: IO(g)+N2O(g)=N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是_____(填标号)。
A.温度升高,该反应速率常数k值增大
B.第三步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2作催化剂,其浓度大小与N2O分解速率无关
(2)温度为T1时,在二个容积均为1L的密闭容器中仅发生反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数。
2NO2(g) △H<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数。
容器编号 | 起始浓度/ mol·L-1 | 平衡浓度/ mol·L-1 | ||
c(NO) | c(O2) | c(NO2) | c(O2) | |
Ⅰ | 0.6 | 0.3 | 0 | 0.2 |
Ⅱ | 0.3 | 0.25 | 0.2 | |
①温度为T1时,![]() =________;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m______n(填“>”“<”或“=”)。
=________;当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m______n(填“>”“<”或“=”)。
②容器Ⅱ中起始时v正_____v逆(填“>”“<”或“=”),理由是_______。
(3)NH3与CO2反应可合成尿素[化学式为CO(NH2)2],反应方程式为2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)在合成塔中进行,下图中Ⅰ、Ⅱ、Ⅲ三条曲线分别表示温度为T℃时,按不同氨碳比
CO(NH2)2(l)+H2O(g)在合成塔中进行,下图中Ⅰ、Ⅱ、Ⅲ三条曲线分别表示温度为T℃时,按不同氨碳比![]() 和水碳比
和水碳比![]() 投料时,二氧化碳平衡转化率的情况。
投料时,二氧化碳平衡转化率的情况。
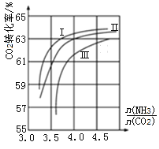
①曲线Ⅰ、Ⅱ、Ⅲ中水碳比的数值分别为0.6~0.7,1~1.1,1.5~1.6,则生产中应选用的水碳比数值范围是______。
②在选择氨碳比时,工程师认为控制在4.0左右比较适宜,不选择4.5,理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7
B.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能
C.高氯酸的酸性与氧化性均大于次氯酸的酸性与氧化性
D.邻羟基苯甲醛的熔点高于对羟基苯甲醛的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示,H+、O2、NO3-等共存物会影响修复效果。下列说法错误的是
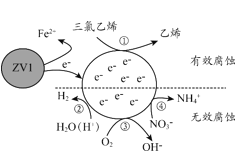
A.反应①②③④均为还原反应
B.1mol三氯乙烯完全脱Cl时,电子转移为3mol
C.④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D.修复过程中可能产生Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是合成农药的重要中间体,其合成路线如下:
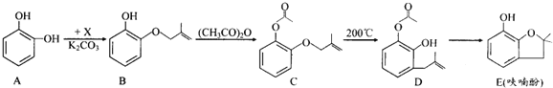
(1)A在空气中久置会由无色转变为棕褐色,其原因是____________,A在核磁共振氢谱中有___________组峰。
(2)B→C的反应类型是_____________________。
(3)已知X的分子式为C4H7Cl。写出A→B的化学方程式:___________________。
(4)要鉴别化合物C和D,适宜的试剂是__________________________。
(5)B的同分异构体很多,符合下列条件的有______种,写出其中能发生银镜反应的同分异构体的结构简式:__________(任写一种)。
①苯的衍生物 ②有两个互为对位的取代基 ③含有酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是 ( )
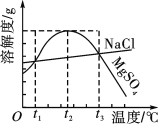
A. 只有在t1 ℃时,NaCl和MgSO4的溶解度才相等
B. t1~t2 ℃,MgSO4的溶解度随温度升高而减小
C. 在t2 ℃时,MgSO4饱和溶液的溶质质量分数最大
D. 把MgSO4饱和溶液的温度从t3 ℃降至t2 ℃时,有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化性:BrO3->IO3->Br2>I2。向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加KBrO3的物质的量的关系如图所示。请回答下列问题:
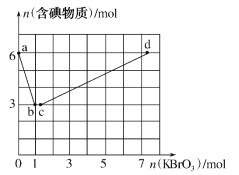
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为__,还原产物是__。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式___。
(3)①已知反应:2BrO3-+I2→2IO3-+Br2;有同学由此得出氧化性:I2>Br2的结论,你认为是否正确___,并说明理由:___。
(4)计算c→d过程中消耗KBrO3的物质的量___。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯胺是一种长效缓释水消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl,NHCl2和NCl3)。工业上可利用NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
NH2Cl(g)+HCl(g)制备一氯胺。回答下列问题:
(1)氯胺作饮用水消毒剂是因为水解生成具有强烈杀菌作用的物质,该物质是___,二氯胺与水反应的化学方程式为___。
(2)已知部分化学键的键能和化学反应的能量变化如表和如图所示(忽略不同物质中同种化学键键能的细微差别)。
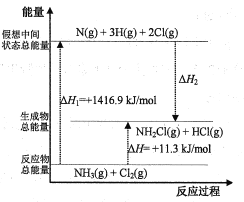
化学键 | N-H | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | x | 431.8 |
则ΔH2=___kJ/mol,x=___。
(3)在密闭容器中反应NH3(g)+Cl2(g) ![]() NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随
NH2Cl(g)+HCl(g)达到平衡,据此反应通过热力学定律计算理论上NH2Cl的体积分数随![]() (氨氯比)的变化曲线如图所示。
(氨氯比)的变化曲线如图所示。
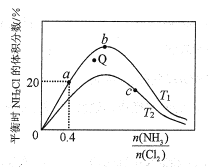
①a、b、c三点对应平衡常数的大小关系是___。T1温度下该反应的平衡常数为___(列出算式即可)。
②在T2温度下,Q点对应的速率:v正___v逆(填“大于”“小于”或“等于”)。
③在氨氯比一定时,提高NH3的转化率的方法是___(任写1种)
④若产物都是气体,实验测得NH2Cl的体积分数始终比理论值低,原因可能是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com