
| A、Fe3+ | B、Ba2+ | C、Cu2+ | D、H+ |


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省咸阳市高考模拟考试(二)理综化学试卷(解析版) 题型:填空题
某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:
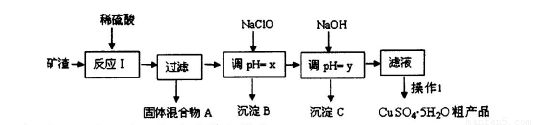
已知: ①Cu2O +2 H+=Cu + Cu2++H2O
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
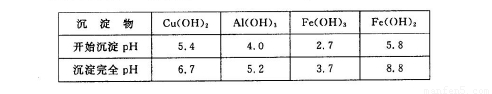
请回答下列问题:
(1)为了加快反应I的速率,可以采取的措施是??????????????????????????? (写2点)。
(2)固体混合物A中的成分是????????????????????????????? 。
(3)反应I完成后,铁元素的存在形式为??? (填离子符号);写出生成该离子的离子方程式?????????? 。
(4)操作1主要包括:?????????? 、???????????? 、??????? 。洗涤CuSO4?5H2O粗产品不能用大量水洗,而用冰水洗涤。原因是????????????????????????????????????????? 。
(5)用惰性电极电解胆矾溶液一段时间,加人0.1 mol的Cu(OH)2可恢复溶液原况(浓度、成分),则电解时转移电子的物质的量为???????????????????????????? .。
(6)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,该反应的离子方程式为 ????????? 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省五校高三第一次联考化学试卷(解析版) 题型:填空题
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2。无隔膜法电解冷的食盐水相应的离子方程式为 。
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

①经精制的饱和NaCl溶液应从图中电解池的 (填写“左” 或“右”)池注入。
②图中X是____ __(填化学式);乙中右室的电极反应式为: _ ,图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母)。
A. a%=b% B. a%﹥b% C. a%﹤b%
③甲中的离子交换膜为 (填“阳离子交换膜”或“阴离子交换膜”)。
(3)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的4种钠盐溶液pH如下表:
|
溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
|
pH |
11.6 |
9.7 |
10.3 |
5.2 |
下列说法中,不正确的是 (填字母)
a.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
b.四种溶液中,水的电离程度最大的是NaClO
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
d.NaHSO3溶液中离子浓度大小顺序为c(Na+)> c(H+)>c(HSO3-) >c(SO32-)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com