
【题目】用如下图装置实验,下列实验现象预期及相应结论均正确的是
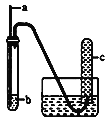
a | b | 实验现象预期 | 结论 | |
A | 铁丝 | HCl酸化的H2O2 | c中收集到无色气体 | 铁丝催化H2O2分解 |
B | 铜丝 | 浓硝酸 | c中收集到红棕色气体 | 硝酸有强氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 木条 | 浓硫酸 | 木条变黑 | 浓硫酸有强氧化性 |
A. A B. B C. C D. D
 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:

下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组学习电化学后。设计了下面的实验装置图(合上电键):
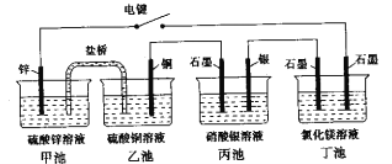
(1)电极名称,铜电极___(填写“正极”、“负极”、“阴极”、“阳极”,下同),银电极_____。
(2)丙池石墨电板上发生的电极反应式为_______,丁池中发生反应的离子方程式为_______。
(3)一段时间,当丙池中生成标准状况下560mL气体时,丁池中理论上最多产生______g固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。

(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ,③的反应类型是 。
(3)反应④ 的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,纯水中存在的平衡:H2O ![]() H+ + OH-,下列叙述正确的是
H+ + OH-,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 加入稀盐酸,平衡逆向移动,c(H+)降低
C. 加入氢氧化钠溶液,平衡逆向移动,Kw变小
D. 加入少量固体CH3COONa,平衡正向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把13g Zn放入足量的盐酸中,Zn完全反应。计算:
(1)13g Zn的物质的量___________
(2)参加反应的HCl的物质的量___________
(3)生成H2的体积(标准状况)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国部分城市灰霾天占全年一半,引起灰霾的 PM2.5 微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气的原因主要是交通污染。
(1)Zn2+在基态时核外电子排布式为_____。
(2)NO3-的立体构型是_____。
(3)PM2.5 含有大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有 NOx、O3、CH2=CH—CHO、HCOOH、CH3COOONO2(PAN)等二次污染物。
①下列说法正确的是_____。
A.N2O 结构式可表示为 N=N=O
B.O3 分子呈直线形
C.CH2=CH—CHO 分子中碳原子均采用 sp2 杂化
D.相同压强下,HCOOH 沸点比 CH3OCH3高,说明前者是极性分子,后者是非极性分子
②1 mol PAN 中含σ键数目为_____(用含 NA的式子表示)。
③NO 能被 FeSO4 溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为_____(填数字)。
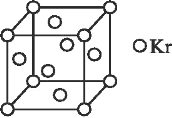
(4)测定大气中 PM2.5 的浓度方法之一是β-射线吸收法,β-射线放射源可用 85Kr,已知 Kr晶体的晶胞结构如图所示,设晶体中与每个 Kr 原子相紧邻的 Kr 原子有 m 个,晶胞中含 Kr
原子为 n 个,则m/n=___(填数字)。
(5)水分子的立体结构是_____,水分子能与很多金属离子形成配合物,其原因是在氧原子上有__________。
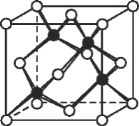
(6)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心所示原子位于立方体的 顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有_____个水分子。 冰晶胞与金刚石晶胞微粒排列方式相同的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然食用香料X是芳香族化合物,可以从某些植物中提取。由X合成H的路线如下:

已知:①A的核磁共振氢谱有6个峰;②H为酯类物质,结构中除苯环外还含有一个六元环;③G的产量是衡量一个国家石油化工发展水平的标志。
请回答下列问题:
(1)A的结构简式为______,检验A中非含氧官能团所用的试剂为_______。
(2)②的反应类型为____________。反应③的化学方程式为_____________。
(3)F中所含官能团的名称为____________,其同分异构体中,遇FeCl3溶液发生显色反应,且能与碳酸氢钠溶液反应,其苯环上一氯代物只有一种,符合条件的同分异构体数目为________种,写出其中一种结构简式:____________。
(4)设计一条以G为起始原料合成乙二酸的路线______________,无机物任选,注明反应条件。示例如下: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com