
| A. | 生活污水使用明矾杀菌消毒 | B. | 向燃煤中加入适量石灰石“固硫” | ||
| C. | 推广使用可降解塑料防止白色污染 | D. | 提倡公交出行可减少氮氧化物排放 |
分析 A.明矾不具有强氧化性;
B.燃煤燃烧产生大量二氧化硫,能够引起空气污染;
C.聚乙烯、聚氯乙烯塑料难降解;
D.汽车尾气中含有大量氮的氧化物.
解答 解:A.明矾不具有强氧化性,不能杀菌消毒,故A错误;
B.燃煤燃烧产生大量二氧化硫,能够引起空气污染,向燃煤中加入适量石灰石“固硫”,能够减少二氧化硫排放,减少酸雨,故B正确;
C.推广使用可降解塑料,可以减少聚乙烯、聚氯乙烯塑料的使用,可以防止白色污染,故C正确;
D.提倡公交出行,减少私家车使用,可减少氮氧化物排放,有利于环境保护,故D正确;
故选:A.
点评 本题考查了化学与生产、生活,熟悉生活中常见的环境污染及治理措施是解题关键,有助于养成爱护环境的习惯,题目难度不.


科目:高中化学 来源: 题型:解答题
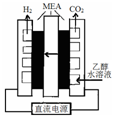 氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下:
氢能是一种极具发展潜力的清洁能源.硫碘循环分解水是最具潜力的制氢方法.其反应原理如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,电解质溶液中K+移向负极 | |
| B. | 放电时,电解质溶液的pH 不变 | |
| C. | 充电时,阴极的反应为:Zn(OH)42-+2e-=Zn+4OH- | |
| D. | 充电时,当有4.48L 氧气(标准状况下)释放出来时,则析出固体Zn为13g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶液与过量NaOH溶液反应 NH4++OH-=NH3↑+H2O | |
| B. | 过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量NaHSO3溶液 2HSO3-+Ba2++2OH-=BaSO3↓+SO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向100ml0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,如图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
常温下,向100ml0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,如图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )| A. | HA为一元弱酸,MOH为一元强碱 | |
| B. | 滴入MOH溶液的体积为50ml时,(M+)>(A-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点时,则有c(MOH)+(M+)=0.02mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| B. | 向某溶液中滴加硝酸酸化的BaCl2溶液产生白色沉淀,则该溶液中含有SO42- | |
| C. | 在电解精炼铜过程中,阳极质量的减少多于阴极质量的增加 | |
| D. | 298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 元素性质或原子结构信息 |
| Q | 原子核外有6种不同运动状态的电子 |
| R | 最外层电子数是次外层电子数的3倍 |
| X | 气态氢化物的水溶液呈弱碱性 |
| Y | 第三周期元素的简单离子中离子半径最小 |
| Z | 单质为银白色固体,在空气中燃烧发出黄色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
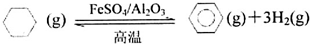
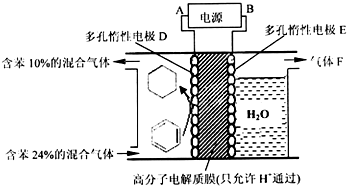
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com