
分析 (1)铜和稀硝酸反应生成硝酸铜、NO和水;
(2)根据反应3Cu+2NO3-+8H+=3Cu2++2NO+4H2O先判断过量,再进行计算解答;
(3)铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,根据二者质量与电子转移列方程计算.
解答 解:(1)铜和稀硝酸反应生成硝酸铜、NO和水,化学方程式为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,其中能拆的是HNO3和Cu(NO3)2,故离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(2)在某100mL混酸中,硝酸的物质的量n(HNO3)=0.1L×0.4mol/L=0.04mol,硫酸的物质的量n(H2SO4)=0.1L×2×0.2moL/L=0.04moL,
所以氢离子的物质的量n(H+)=0.04moL+2×0.04moL=0.08mol,
铜粉的物质的量=$\frac{2.56g}{64g/mol}$=0.04mol,依据方程式:
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
3 2 8
0.04mol 0.04mol 0.08mol 可知氢离子不足,故根据H+计算,由方程式可知n(Cu2+)=$\frac{3}{8}$×0.08mol=0.03mol,
所以C(Cu2+)=$\frac{0.03mol}{0.1L}$=0.3mol/L,故答案为:0.3mol/L;
(3)铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,
n(O2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
设Cu、Ag的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×108g/mol=14g
根据电子守恒列方程:2x+1×y=0.05mol×4
解得:x=0.05mol;y=0.1mol
m(Cu)=0.05mol×64g/mol=3.2g;
故答案为:3.2 g.
点评 本题考查了硝酸性质的分析应用,离子方程式的书写和计算应用,混合计算、氧化还原反应的有关计算,难度中等,根据始态终态法判断金属提供的电子等于氧气获得的电子是关键,注意氧化还原反应中守恒思想的运用.


科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.25 mol/(L•min) | B. | v(B)=0.6 mol/(L•min) | ||
| C. | v (C)=0.3 mol/(L•min) | D. | v(D)=0.1 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
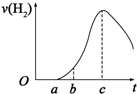 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熟石膏的化学式:2CaSO4•H2O | B. | 明矾的化学式KAlSO4•12H2O | ||
| C. | CaCl2的电子式: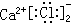 | D. | 氯化钠的电子式Na:$\underset{\stackrel{..}{Cl}}{..}$: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 非金属性:F>O>S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
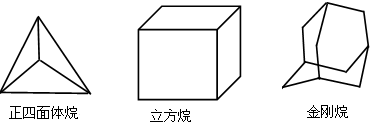 科学研究发现,具有高度对称性的有机分子具有致密性高,稳定性强,张力能大等特点,因此这些分子成为2014年化学界关注的热点,下面是几种常见高度对称烷烃的分子碳架结构这三种烷烃的二氯取代产物的同分异构体数目是( )
科学研究发现,具有高度对称性的有机分子具有致密性高,稳定性强,张力能大等特点,因此这些分子成为2014年化学界关注的热点,下面是几种常见高度对称烷烃的分子碳架结构这三种烷烃的二氯取代产物的同分异构体数目是( )| A. | 2种4种 8种 | B. | 2种4种6种 | C. | 1种3种6种 | D. | 1种3种 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液中:Na+,H+,NO3- | B. | 碘化钾溶液中:H+,H2O,SO32- | ||
| C. | 偏铝酸钠溶液中:K+,Cl-,SO42- | D. | 氢氧化钙溶液中:Na+,ClO-,HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com