
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 5.0×10-13 | 8.3×10-17 |
| A、五种物质在常温下溶解度最大的是Ag2SO4 |
| B、向AgCl的悬浊液中加入0.1mol/L Na2S溶液,则可以生成黑色的Ag2S沉淀 |
| C、外界条件改变时,沉淀溶解平衡也会发生移动 |
| D、常温下,向AgI的悬浊液中加入0.1mol/L NaCl溶液,黄色沉淀变成白色沉淀 |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,0.1NA个HCl分子的体积为2.24L |
| B、标准状况下,22.4L 氖气含有2NA 个原子 |
| C、1L 0.2mol/L 硫酸铁溶液中含有的SO42- 离子数目为0.2 NA |
| D、1 mol氖中含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
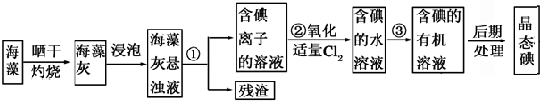

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饮用酸性饮料 |
| B、在牙膏中添加适量的Ca2+离子 |
| C、少吃甜食 |
| D、在牙膏中加入氟化物添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可以根据PbI2和AgCl的Ksp的大小比较两者的溶解度 |
| B、常温下,同浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大 |
| C、等物质的量浓度的CH3COONH4溶液和NH4HSO4溶液,前者的c(NH4+)小 |
| D、用惰性电极电解饱和NaCl溶液,若有1.0 mol电子转移,则理论生成1.0 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中含有大量Mg2+、Al3+、Fe3+、Ag+、Ba2+等离子.试分析回答下列问题:
在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中含有大量Mg2+、Al3+、Fe3+、Ag+、Ba2+等离子.试分析回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、欲配制质量分数为10%的ZnSO4溶液,将5g ZnSO4溶解在45g水中 |
| B、在25℃温度条件下,配制100g溶解度为25g的NaCl饱和溶液,将25g的NaCl溶解在75g水中 |
| C、加热蒸发质量分数为10%的盐酸,可得到质量分数为36.5%的浓盐酸 |
| D、向25℃的饱和CuSO4溶液中加入CuSO4粉末,制备CuSO4?5H2O晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com