
| A、若混合后呈中性,则混合后的溶液中一定存在:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(OH-)=c(H+) |
| B、若混合后呈酸性,则混合后的溶液中可能存在:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C、若混合后呈碱性,则混合后的溶液中可能存在:c(Na+)>c(OH-)>c(CH3COO-)>c(CH3COOH)>c(H+) |
| D、若混合后的溶液中存在c(CH3COO-)+c(CH3COOH)=2c(Na+)等式,则也一定存在c(OH-)+c(CH3COO-)=c(CH3COOH)+c(H+)等式 |


科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 分离沸点相差较大液体混合物 |
B、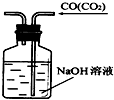 除去CO气体中的CO2气体 |
C、 向容量瓶中转移液体 |
D、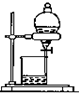 分离互不相溶的两种液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、密度比为2:1 |
| B、氢原子数之为3:2 |
| C、体积比为2:1 |
| D、氮原子与硫原子质量为7:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0.01mol?L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol?L-1Na2SO3 溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com