
有A、B、C三种晶体,分别由H、C、Na、Cl 4种元素的一种或几种形成,对这3种晶体进行实验,结果如下表:
| 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 | |
| A | 811 | 较大 | 易溶 | 水溶液或熔融导电 | 白色沉淀 |
| B | 3 550 | 很大 | 不溶 | 不导电 | 不反应 |
| C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体的化学式分别为:A________、B________、C________。
(2)晶体的类型分别是:A________、B________、C________。
(3)晶体中微粒间的作用力分别是:A________________、B________________、
C________________。
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
右图是一个用铂丝作电极,电解足量的稀MgSO4溶液的装置.
回答下列问题:
(1)写出A管中发生反应的反应式______________________________________________;
(2)写出B管中发生反应的反应式_________________________________________;
(3)检验a管中气体的方法是___________________________________________________;
(4)检验b管中气体的方法是___________________________________________________;
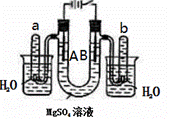 (5)电解一段时间后,切断电源,将电解液导入烧杯内观察到的现象是__________________.
(5)电解一段时间后,切断电源,将电解液导入烧杯内观察到的现象是__________________.
(6)电解一段时间后,若加入4.5克水溶液恢复到原来的浓度,则电路中转移电子数目为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲型H1N1是一种病毒,只要破坏病毒内部的蛋白质,就可以杀死病毒。根据你所学知识判断下列预防甲型流感的措施中不正确的是( )
A.甲型H1N1病毒是一种氨基酸,进入人体内能合成对人体有害的蛋白质
B.养成良好的个人生活习惯,如多吃水果、蔬菜,多锻炼,多饮水,吃营养丰富的食品,增强抵抗能力
C.高温或使用消毒剂可以有效杀死甲型H1N1病毒
D.没有蛋白质就没有生命,但并不是所有蛋白质对人体都是有利的
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A分子式为CxHyOz,15 g A完全燃烧生成22 g CO2和9 g H2O。
(1)该有机物的最简式为____________________。
(2)若A和Na2CO3混合有气体放出,和醇发生酯化反应,则A的结构简式为____________________________。
(3)若A是易挥发、有水果香味的液体,能发生水解反应,则其结构简式为__________________________________。
(4)若其分子结构中含有6个碳原子,是人体的基本营养物质,则其结构简式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,按熔点由低到高的顺序排列正确的是 ( )。
①O2、I2、Hg ②CO、KCl、SiO2 ③Na、K、Rb ④Na、Mg、Al
A.①③ B.①④ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是 ( )。
A.氢键;分子间作用力;极性键
B.氢键;氢键;非极性键
C.氢键;极性键;分子间作用力
D.分子间作用力;氢键;非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为: ____________________________,
Y元素原子最外层电子的电子排布图为:____________________________。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间
的化学键为 (填“共价键”或“离子键”)。
(3)该化合物的空间结构为 ,中心原子的杂化类型为 ,
分子为 (填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是 。
(5)该化合物的沸点与SiCl4比较: (填化学式)的高,原因是
_________________________________________________________________
________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
地壳中含量第一和第二的两元素形成的化合物,不具有的性质是 ( )。
A.在一定条件下可与NaOH溶液反应
B.与碳在高温下反应可制取两元素中的一种单质
C.熔点很高,可用作耐火材料
D.是酸酐,与水反应生成相应的酸
查看答案和解析>>
科目:高中化学 来源: 题型:
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
|
| A. | 加热 |
|
| B. | 不用稀硫酸,改用98%的浓硫酸 |
|
| C. | 滴加少量CuSO4溶液 |
|
| D. | 不用铁片,改用铁粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com