
(6 分)二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
(1)该条件下反应平衡常数表达式K=________。在T1℃时,反应的平衡常数为________;
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4 mol·L-1,c(H2O)=0.6 mol·L-1、c(CH3OCH3)=1.2 mol·L-1,此时正、逆反应速率的大小:v(正)________v(逆)(填“>”、“<”或“=”)。
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:填空题
(6分)将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g) xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1),下列说法正确的是
CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1),下列说法正确的是
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
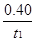 mol·L-1·min-1
mol·L-1·min-1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯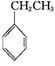 (g)+CO2(g)
(g)+CO2(g)
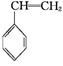 (g)+CO(g)+H2O(g)ΔH="-166" kJ·mol-1
(g)+CO(g)+H2O(g)ΔH="-166" kJ·mol-1
(1)①乙苯与CO2反应的平衡常数表达式为:K= 。
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。 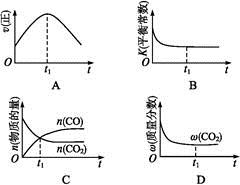
(2)在3 L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0 mol·L-1和3.0 mol·L-1,其中实验Ⅰ在T1℃,0.3 MPa,而实验Ⅱ、III分别改变了实验其他条件;乙苯的浓度随时间的变化如图1所示。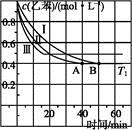

图1 图2
①实验Ⅰ乙苯在0~50 min时的反应速率为 。
②实验Ⅱ可能改变的条件是 。
③图2是实验Ⅰ中苯乙烯体积分数V%随时间t的变化曲线,请在图2中补画实验III中苯乙烯体积分数V%随时间t的变化曲线。
(3)若实验Ⅰ中将乙苯的起始浓度改为1.2 mol·L-1,其他条件不变,乙苯的转化率将 (填“增大”“减小”或“不变”),计算此时平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
t ℃时,将3 mol A和1 mol B气体通入体积为2 L的密闭容器中(容积不变),发生反应:3A(g)+B(g) xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________。
(2)x=________;平衡常数K=________。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡________(填写字母序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)若向原平衡混合物的容器中再充入a mol C,在t ℃时达到新的平衡,此时B的物质的量为n(B)=________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化碳捕集、存储和转化是当今化学研究的热点问题之一。
(1)用钌的配合物作催化剂,一定条件下可直接光催化分解CO2,发生反应:2CO2(g)=2CO(g)+O2(g),该反应的ΔH 0,ΔS 0(选填“>”、“<”或“=”),在低温下,该反应 (填“能”或“不能”)自发进行。
(2)CO2转化途径之一是利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇或其他化学品。你认为该方法需要解决的技术问题有 。
a.开发高效光催化剂
b.将光催化制取的氢气从反应体系中有效分离,并与CO2发生催化转化
c.二氧化碳及水资源的供应
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为 热反应,m+n p(填“>”“=”“<”)。
(2)减压时,A的质量分数 。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率 ,B的的转化率 。
(4)若升高温度,则平衡时B、C的浓度之比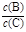 将 。
将 。
(5)若加入催化剂,平衡时气体混合物的总物质的量 。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色 ;而维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用如图所示装置进行如下实验:
(1)在检查装置的气密性后,向试管a中加入10 mL 6 mol·L-1的稀硝酸和1 g铜片,立即用带有导管的橡皮塞塞紧试管口。请写出在试管a中有可能发生的所有反应的化学方程式 。
(2)在实验过程中常常反应开始时速率缓慢,随后逐渐加快,这是由于 ,当反应进行一段时间后速率又逐渐减慢,原因是 。
(3)欲较快地制得NO,可采取的措施是 (填写字母序号)。
| A.加热 | B.使用铜粉 | C.稀释HNO3 | D.增大硝酸的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g)  CO2(g)+3H2(g) ΔH>0
CO2(g)+3H2(g) ΔH>0
(1)一定条件下,向体积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),20 s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为________。
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号)________。
①v正(CH3OH)=v正(CO2)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1 mol CH3OH(g)和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为a L。试回答: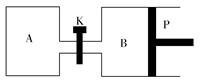
①反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为________,A、B两容器中H2O(g)的体积百分含量的大小关系为:B(填“>”“<”或“=”)________A。
②若打开K,一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com