

| �¶�/�� | 400 | 500 | 830 |
| ƽ�ⳣ��K | 10 | 9 | 1 |
���� ����ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ��������ת��������
100��ʱ����1mol CH4��2mol H2Oͨ���ݻ�Ϊ100L�ĺ����ܱ������У��ﵽƽ��ʱCH4��ת����Ϊ0.5����ת���ļ���Ϊ0.5mol����
CH4��g��+H2O��g��?CO��g��+3H2��g��
��ʼŨ�ȣ�mol/L����0.01 0.02 0 0
�仯Ũ�ȣ�mol/L����0.005 0.005 0.005 0.015
ƽ��Ũ�ȣ�mol/L����0.005 0.015 0.005 0.015
�ٸ���K=$\frac{c��CO����{c}^{3}��{H}_{2}��}{c��C{H}_{4}����c��{H}_{2}O��}$����ƽ�ⳣ����
�ڶ���������Ӧ��CO��g��+H2O��g��?H2��g��+CO2��g�����ɱ������ݿ�֪�����¶�����ƽ�ⳣ����С��˵�������¶�ƽ�������ƶ����������¶�ƽ�������ȷ�Ӧ�����ƶ���
����500����ƽ��ʱCO��ת����Ϊx����ʾ��ƽ��ʱ��������ʵ���Ũ�ȣ��ٸ���K=$\frac{c��{H}_{2}����c��C{O}_{2}��}{c��CO����c��{H}_{2}O��}$=9�з��̼��㣻
t2ʱ�̺�CO��Ũ�ȼ�С��CO2Ũ������ƽ��������Ӧ�����ƶ�������ͨ���ı��¶ȡ��ı�ˮ��������������ʵ�֣�
��CO��CH3OH��ȼ���ȷֱ�Ϊ283.0kJ•mol-1��726.5kJ•mol-1���ɵ��Ȼ�ѧ����ʽ��
��CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-283.0kJ•mol-1
��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2 H2O��l����H=-726.5kJ•mol-1
�ɸ�˹���ɿ�֪����-��÷�Ӧ��CH3OH��l��+O2��g��=CO��g��+2 H2O��l����
�ںϳɼ״��Ƿ��ȷ�Ӧ�������¶�ƽ�������ƶ������¶�Խ��ת����ԽС��
��ͼ��֪��ת������ͬʱ��Ͷ�ϱ�Խ�ߣ���Ӧ�ķ�Ӧ�¶�Խ�ߣ�
�۵�Ͷ�ϱ�Ϊ1��1���¶�Ϊ230�棬����Ϊx����ͼ��֪CO��ת����Ϊ40%��
CO��g��+2H2��g��?CH3OH��g��
��ʼ����mol�� a a 0
�仯����mol�� 0.4a 0.8a 0.4a
ƽ������mol��0.6a 0.2a 0.4a
��������CH3OH�����ʵ���������
��� �⣺��ͼ��֪����ͬ�¶��£�ѹǿP1ʱ����ת���ʴ���ѹǿP2�ģ�����ӦΪ���������С�ķ�Ӧ������ѹǿƽ�������ƶ��������ת����������P1��P2��
100��ʱ����1mol CH4��2mol H2Oͨ���ݻ�Ϊ100L�ĺ����ܱ������У��ﵽƽ��ʱCH4��ת����Ϊ0.5����ת���ļ���Ϊ0.5mol����
CH4��g��+H2O��g��?CO��g��+3H2��g��
��ʼŨ�ȣ�mol/L����0.01 0.02 0 0
�仯Ũ�ȣ�mol/L����0.005 0.005 0.005 0.015
ƽ��Ũ�ȣ�mol/L����0.005 0.015 0.005 0.015
��ƽ�ⳣ��K=$\frac{c��CO����{c}^{3}��{H}_{2}��}{c��C{H}_{4}����c��{H}_{2}O��}$=$\frac{0.005��0.01{5}^{3}}{0.005��0.015}$=2.25��10-4��
�ڶ���������Ӧ��CO��g��+H2O��g��?H2��g��+CO2��g�����ɱ������ݿ�֪�����¶�����ƽ�ⳣ����С��˵�������¶�ƽ�������ƶ����������¶�ƽ�������ȷ�Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ��
����500����ƽ��ʱCO��ת����Ϊx����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼŨ�ȣ�mol/L����0.02 0.02 0 0
�仯Ũ�ȣ�mol/L����0.02x 0.02x 0.02x 0.02x
ƽ��Ũ�ȣ�mol/L����0.02��1-x�� 0.02��1-x�� 0.02x 0.02x
��K=$\frac{c��{H}_{2}����c��C{O}_{2}��}{c��CO����c��{H}_{2}O��}$=$\frac{0.02x��0.02x}{0.02��1-x����0.02��1-x��}$=9�����x=75%��
t2ʱ�̺�CO��Ũ�ȼ�С��CO2Ũ������ƽ��������Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ�����Խ����¶ȣ�������ˮ�������������������������
��CO��CH3OH��ȼ���ȷֱ�Ϊ283.0kJ•mol-1��726.5kJ•mol-1���ɵ��Ȼ�ѧ����ʽ��
��CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-283.0kJ•mol-1
��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2 H2O��l����H=-726.5kJ•mol-1
�ɸ�˹���ɿ�֪����-��÷�Ӧ��CH3OH��l��+O2��g��=CO��g��+2 H2O��l�������H=-726.5kJ•mol-1-��-283.0kJ•mol-1��=-443.5kJ•mol-1��
���Ȼ�ѧ����ʽΪ��CH3OH��l��+O2��g��=CO��g��+2 H2O��l����H=-443.5kJ•mol-1��
�ںϳɼ״��Ƿ��ȷ�Ӧ�������¶�ƽ�������ƶ������¶�Խ��ת����ԽС��270���ʵ��������Ӧ��������Z����ͼ��֪��ת������ͬʱ��Ͷ�ϱ�Խ�ߣ���Ӧ�ķ�Ӧ�¶�Խ�ߣ�
�۵�Ͷ�ϱ�Ϊ1��1���¶�Ϊ230�棬����Ϊx����ͼ��֪CO��ת����Ϊ40%��
CO��g��+2H2��g��?CH3OH��g��
��ʼ����mol�� a a 0
�仯����mol�� 0.4a 0.8a 0.4a
ƽ������mol��0.6a 0.2a 0.4a
��ƽ��ʱCH3OH�����ʵ�������Ϊ$\frac{0.4a}{1.2a}$��100%=33.3%��
�ʴ�Ϊ������2.25��10-4�����ȣ�75%�������¶ȣ�������ˮ�������������������������
CH3OH��l��+O2��g��=CO��g��+2 H2O��l����H=-443.5kJ•mol-1��
Z��Ͷ�ϱ�Խ�ߣ���Ӧ�ķ�Ӧ�¶�Խ�ߣ�33.3%��
���� ���⿼�黯ѧƽ�������Ӱ�����ء�ƽ�ⳣ�����㡢��ѧƽ��ͼ��˹����Ӧ�õȣ����ؿ���ѧ������������������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ������� | ��ʼʱ���������ʵ���/mol | �ﵽƽ���ʱ��/min | ��ƽ��ʱ��ϵ�����ı仯/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| �� | 1 | 4 | 0 | 0 | t1 | �ų�������32.8 kJ | |
| �� | 2 | 8 | 0 | 0 | t2 | �ų�������Q | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
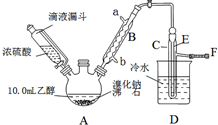 ʵ�������Ҵ���Ũ������廯�Ʒ�Ӧ���Ʊ������飬�䷴Ӧԭ����ʵ���װ�����£���Ӧ��Ҫ���ȣ�ͼ��ʡȥ�˼���װ�ã���H2SO4��Ũ��+NaBr$\frac{\underline{\;\;��\;\;}}{\;}$NaHSO4+HBr����CH3CH2OH+HBr$\stackrel{��}{��}$CH3CH2Br+H2O���й����ݼ�����
ʵ�������Ҵ���Ũ������廯�Ʒ�Ӧ���Ʊ������飬�䷴Ӧԭ����ʵ���װ�����£���Ӧ��Ҫ���ȣ�ͼ��ʡȥ�˼���װ�ã���H2SO4��Ũ��+NaBr$\frac{\underline{\;\;��\;\;}}{\;}$NaHSO4+HBr����CH3CH2OH+HBr$\stackrel{��}{��}$CH3CH2Br+H2O���й����ݼ�����| �Ҵ� | ������ | �� | |
| ״̬ | ��ɫҺ�� | ��ɫҺ�� | ���ɫҺ�� |
| �ܶ�/��g•cm-3�� | 0.79 | 1.44 | 3.1 |
| �е�/�� | 78.5 | 38.4 | 59 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢܢݢ� | B�� | �٢ڢۢܢݢ� | C�� | �٢ڢۢޢ� | D�� | �ڢޢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
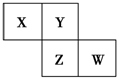 X��Y��Z��W��Ϊ������Ԫ�أ����������ڱ��е����λ����ͼ��ʾ����Yԭ�ӵ��������������ڲ��������3��������˵������ȷ���ǣ�������
X��Y��Z��W��Ϊ������Ԫ�أ����������ڱ��е����λ����ͼ��ʾ����Yԭ�ӵ��������������ڲ��������3��������˵������ȷ���ǣ�������| A�� | ����Ԫ�صļ��⻯�ﶼΪ���Է��� | |
| B�� | ����������Ӧ��ˮ���������W��Z�� | |
| C�� | Z�ĵ�����������Ӧ��Y���� | |
| D�� | X��Y�γɵĻ����ﶼ������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com