

 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同| A. | ①②⑤ | B. | ③④⑦ | C. | ①④⑥ | D. | ④⑤⑥ |
分析 ①二氧化碳为直线型结构;
②-OH与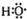 分别为羟基的结构简式和电子式;
分别为羟基的结构简式和电子式;
③书写结构简式时注意C≡N三键不能省略;
④HCO3-在水中部分电离;
⑤Na2O与水反应生成电解质;
⑥铝属于两性物质;
⑦分馏是利用沸点不同分离液体的方法,是物理变化.
解答 解:①二氧化碳为直线型结构,其正确的比例模型为 ,故错误;
,故错误;
②-OH与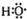 分别为羟基的结构简式和电子式,组成元素相同,含有的电子数也相同,故正确;
分别为羟基的结构简式和电子式,组成元素相同,含有的电子数也相同,故正确;
③HCN分子中存在C-H和C≡N,其结构式为H-C≡N,故正确;
④HCO3-在水中部分电离,所以NaHCO3在水中的电离方程式为NaHCO3=Na++HCO3-,故错误;
⑤Na2O与水反应生成电解质NaOH,所以Na2O的水溶液能导电,这不能说明Na2O是电解质,故正确;
⑥铝既能与酸反应,又能与强碱溶液反应,但不属于两性物质,故错误;
⑦分馏是利用沸点不同分离液体的方法,过程中没有新物质生成,是物理变化,干馏、裂化都是化学变化,故正确.
故选C.
点评 本题考查了化学用语的判断,属于基础知识的考查,题目难度中等,注意掌握常见有机物的表示方法,试题考查了学生规范答题的能力.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、D2互为同位素 | B. | 碘晶体、碘蒸气是同素异形体 | ||
| C. | NH4OCN、CO(NH2)2互为同分异构体 | D. | C2H4与C3H6一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$(lgc-lgb) | B. | $\frac{1}{2}$(lgb-lgc) | C. | $\frac{1}{2}$(lgb-lgc)-a | D. | $\frac{1}{2}$(lgc-lgb)-a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅可用于制作半导体材料 | B. | 碳酸钠可用于制胃酸中和剂 | ||
| C. | 氧化铁可用于制作红色涂料 | D. | 氢氟酸可用于雕刻玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com