
【题目】下列各组中的微粒在指定溶液中一定能大量共存的是( )
A. c(FeCl3)=1.0 mol·L-1的溶液中:HCO![]() 、Cl-、H+、Na+
、Cl-、H+、Na+
B. 常温下,由水电离出的c(H+)=10-14mol·L-1溶液中:NH![]() 、K+、CO
、K+、CO![]() 、SO
、SO![]()
C. 在c(HCO![]() )=0.1 mol·L-1的溶液中:NH
)=0.1 mol·L-1的溶液中:NH![]() 、AlO
、AlO![]() 、Cl-、NO
、Cl-、NO![]()
D. 常温下, 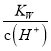 =0.1 mol·L-1的溶液中:K+、NH3·H2O、SO
=0.1 mol·L-1的溶液中:K+、NH3·H2O、SO![]() 、NO
、NO![]()
【答案】D
【解析】A. HCO![]() 与H+不能大量共存,而且HCO
与H+不能大量共存,而且HCO![]() 不能大量存在于c(FeCl3)=1.0 mol·L-1的溶液中,A不正确;B. 常温下,由水电离出的c(H+)=10-14mol·L-1溶液中,水的电离受到了强酸或强碱的抑制,溶液可能显酸性、也可能显碱性,NH
不能大量存在于c(FeCl3)=1.0 mol·L-1的溶液中,A不正确;B. 常温下,由水电离出的c(H+)=10-14mol·L-1溶液中,水的电离受到了强酸或强碱的抑制,溶液可能显酸性、也可能显碱性,NH![]() 不能大量存在于碱性溶液中,CO
不能大量存在于碱性溶液中,CO![]() 不能大量存在于酸性溶液中,B不正确;C. 在c(HCO
不能大量存在于酸性溶液中,B不正确;C. 在c(HCO![]() )=0.1 mol·L-1的溶液中,AlO
)=0.1 mol·L-1的溶液中,AlO![]() 不能大量存在,这两种离子会发生反应,生成碳酸根离子和氢氧化铝沉淀,C不正确;D. 常温下,
不能大量存在,这两种离子会发生反应,生成碳酸根离子和氢氧化铝沉淀,C不正确;D. 常温下, 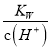 =0.1 mol·L-1的溶液显碱性,K+、NH3·H2O、SO
=0.1 mol·L-1的溶液显碱性,K+、NH3·H2O、SO![]() 、NO
、NO![]() 等4种粒子可以大量共存,D正确。本题选D。
等4种粒子可以大量共存,D正确。本题选D。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 将 Cl2 通入水中: Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向 Fe2(SO4)3 溶液中加入过量铁粉: Fe3++Fe=2Fe2+
C. 将 SO2 通入双氧水中: SO2+H2O2=2H++SO42-
D. 向 Na2SiO3 溶液中滴加稀盐酸: Na2SiO3+2H+=H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32ˉ、SO32ˉ、SO42ˉ、C1ˉ中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法不正确的是

A.气体A是NO
B.X中不能确定的离子是 A13+和C1ˉ
C.溶液E和气体F能发生化学反应
D.X中肯定存在Fe2+、A13+、NH4+、SO42ˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3 与稀硫酸反应的化学方程式为__________________________。
(2)加入H2O2 氧化时,发生反应的离子方程式为__________________________。
(3)滤渣2 的成分是____________(填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑ MgSO4+C
2MgO+2SO2↑+CO2↑ MgSO4+C![]() MgO+SO2↑+CO↑ MgSO4+3C
MgO+SO2↑+CO↑ MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中通过排水法收集的气体可以是___________(填化学式)。
②C中溶液用于吸收CO2,B中盛放的溶液可以是___________(填字母)。
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)3 胶体和 MgCl2 溶液共同具有的性质是
A.都是无色透明的溶液
B.分散质粒子都可通过滤纸
C.加入盐酸后都无明显现象
D.都有丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A. 0.1 mol·L-1 NH4HS溶液中有:c(NH![]() )<c(HS-)+c(S2-)+c(H2S)
)<c(HS-)+c(S2-)+c(H2S)
B. 25 ℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合后,c(NH![]() )=c(Cl-),则NH3·H2O的电离常数为
)=c(Cl-),则NH3·H2O的电离常数为![]()
C. 等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN)
D. 等pH的HA和HB溶液,分别与一定浓度的氢氧化钠溶液完全中和,HA消耗的氢氧化钠溶液体积多,则可证明酸性HA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。已知t ℃时AgCl的Ksp=4×10-10,下列说法正确的是( )

A. 加入NaBr固体,AgBr的溶解度减小,Ksp也减小
B. 在AgBr饱和溶液中加入固体NaBr,可使溶液中c点变到b点
C. 图中a点对应的是有AgBr沉淀生成
D. 在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学为探究酸性KMnO4溶液和H2C2O4(草酸,二元弱酸)溶液的反应过程,进行如下实验。请完成以下问题:
①写出酸性KMnO4溶液和H2C2O4的离子方程式___________________________________。
②配制100mL0.0400mol·L-1的H2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是_______________________________________。
③将KMnO4溶液逐滴滴入一定体积的酸性H2C2O4溶液中(温度相同,并振荡),记录的现象如下:
滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
先滴入第1滴 | 60s |
褪色后,再滴入第2滴 | 15s |
褪色后,再滴入第3滴 | 3s |
褪色后,再滴入第4滴 | 1s |
请分析KMnO4溶液褪色时间变化的可能原因___________________________________。
(2)![]() 和
和![]() 在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中![]() 随c(H+)的变化如图所示
随c(H+)的变化如图所示

①用离子方程式表示溶液中![]() 和
和![]() 的转化反应_________。
的转化反应_________。
②由图可知,溶液酸性减小, ![]() 的平衡转化率_________(填“增大”“减小”或“不变”)。
的平衡转化率_________(填“增大”“减小”或“不变”)。
③升高温度,溶液中![]() 的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com