
| A. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 | |
| B. | H2O2、Na202、SO2都具有漂白性且漂白原理相同 | |
| C. | 饱和Na2C03溶液中通入CO2溶液会变浑浊 | |
| D. | 可用石灰水吸收尾气中的S02气体 |
分析 A.铁与水蒸气在高温下反应生成的是四氧化三铁,不是氢氧化铁;
B.双氧水和过氧化钠的漂白利用的是强氧化性,而二氧化硫的漂白是生成的一种无色物质,不是利用强氧化性;
C.碳酸钠的溶解度大于碳酸氢钠,则饱和碳酸钠溶液中通入二氧化碳会析出碳酸氢钠;
D.石灰水中氢氧化钙的浓度太小,应该用强碱溶液吸收二氧化硫.
解答 解:A.Na、Al的金属单质在一定条件下与水反应都生成H2和对应的碱,但是Fe与水反应生成的氢气和四氧化三铁,故A错误;
B.H2O2、Na202的漂白利用的是其强氧化性,而SO2的漂白是二氧化硫与有色物质反应生成一种不稳定的无色物质,利用的不是强氧化性,故B错误;
C.由于碳酸钠的溶解度大于碳酸氢钠,则饱和Na2C03溶液中通入CO2溶液,碳酸钠转化成碳酸氢钠,溶液会变浑浊,故C正确;
D.二氧化硫属于酸性氧化物,其尾气用碱性物质吸收,但氢氧化钙溶解度较小,应该用强碱溶液,如氢氧化钠溶液,故D错误;
故选C.
点评 本题考查了常见金属元素及其化合物性质的综合应用,题目难度中等,明确常见元素及其化合物性质为解答关键,B为易错点,注意二氧化硫的漂白原理,试题有利于提高学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入碳酸锰的目的是除去Fe3+ | |
| B. | 常温下pH=4时,Fe3+已除尽 | |
| C. | Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)的K=2.73×10-23 | |
| D. | Mn2(OH)2CO3、Mn(OH)2都可以替代MnCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有需要加热的化学反应都是吸热反应 | |
| C. | 开发利用可燃冰是缓解能源紧缺的唯一途径 | |
| D. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
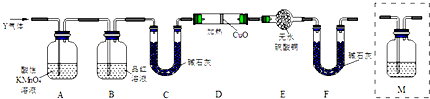
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
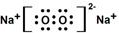 ,该物质所含有的微粒间作用力的类型为离子键、共价键.
,该物质所含有的微粒间作用力的类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
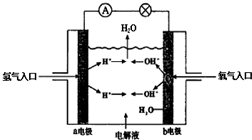
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 原子半径大小:Al>P>N | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{12n}{m}$ | B. | $\frac{60n}{m}$ | C. | $\frac{11m}{120n}$ | D. | $\frac{120n}{11m}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)•c(OH- )乘积不变 | B. | pH增大了 | ||
| C. | c(OH- )降低了 | D. | 水电离出的c(H+)降低了 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com