
【题目】有机物F为某增香剂前驱体,其合成路线如图所示(部分反应条件已略去):
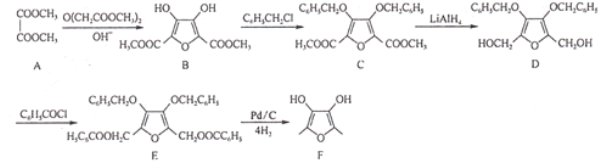
回答下列问题:
(1)A的化学名称为________。
(2)B中除羟基外,其他含氧官能团的名称为________,确定是否存在这些官能团,常用的检测手段是________(填字母)。
a.核磁共振氢谱法b.质谱法
c.红外光谱法d.X一射线衍射法
(3)由B生成C的反应类型为________,设置该步骤的目的是________。
(4)写出由D生成E的化学方程式:________。
(5)写出一种同时满足下列四个条件的B的同分异构体的结构简式:________。
a.属于芳香族化合物,不存在“—O—O—”结构;
b.lmol该物质最多消耗5molNaOH,且与足量的NaHCO3溶液反应最多可生成22.4LCO2(标准状况),
c.核磁共振氢谱显示有4种不同化学环境的氢.
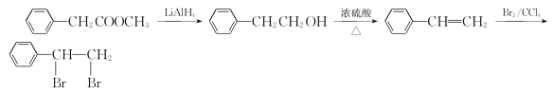
(6)参照上述合成路线,写出以![]() 为原料制备
为原料制备![]() 的合成路线:________。(无机试剂任选)。
的合成路线:________。(无机试剂任选)。
【答案】乙二酸二甲酯 醚键、酯基 c 取代反应 保护羟基 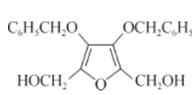 +2C6H5COCl→
+2C6H5COCl→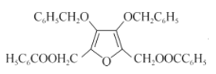 +2HCl
+2HCl 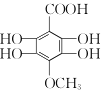
【解析】
(1)由A的结构简式和官能团的特征,A为二元酯,然后命名;
(2)根据B的结构简式判断B中含有的官能团有碳碳双键、羟基、酯基、醚键;
(3)结合反应物、生成物的结构简式确定由B生成C的反应类型;
(4)结合反应物、生成物的结构简式确定由D生成E的反应反应类型,并写出方程式;
(5)结合B的结构简式,确定B的分子式,由分子式按照满足的条件书写其同分异构体;
(6)结合所学知识和有机物F的合成路线图中的信息,进行以![]() 为原料制备
为原料制备![]() ,
,![]() 可由苯乙烯和Br2发生加成反应得到,苯乙烯可由苯乙醇发生消去反应得到,苯乙醇可由苯乙酸甲酯发生还原反应得到。
可由苯乙烯和Br2发生加成反应得到,苯乙烯可由苯乙醇发生消去反应得到,苯乙醇可由苯乙酸甲酯发生还原反应得到。
(1)由A的结构简式可以A是一个二元酯,有乙二酸和甲醇发生酯化反应生成的,故A的名称为乙二酸二甲酯;
(2)B中含有的官能团有碳碳双键、羟基、酯基、醚键,故B中含有的含氧官能团除羟基外,为酯基、醚键;
a.核磁共振氢谱法是判断氢原子种类及个数比,a不符合题意;
b.质谱法是判断其相对分子质量,b不符合题意;
c.红外光谱法是检测官能团及结构,c符合题意;
d.X一射线衍射法是判断晶体和非晶体,d不符合题意;
答案选c;
(3)结合B、C的结构简式,由B生成C的反应类型为取代反应,因为酚羟基的还原性比较强,所以设置该步骤的目的是保护酚羟基,防止酚羟基被氧化;
(4)由D、E的结构简式,由D生成E的反应为取代反应,反应方程式为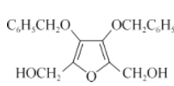 +2C6H5COCl→
+2C6H5COCl→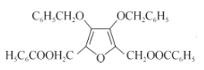 +2HCl ;
+2HCl ;
(5)同时满足下列四个条件的B的同分异构体:a.属于芳香族化合物,不存在“—O—O—”结构,结合B的分子式,说明分子中含有一个苯环;b.lmol该物质最多消耗5molNaOH,且与足量的NaHCO3溶液反应最多可生成22.4LCO2(标准状况),说明分子中含有1个—COOH,4个酚羟基,根据氧原子的个数,分子中还含有1个含氧官能团;c.核磁共振氢谱显示有4种不同化学环境的氢,符合条件的结构简式有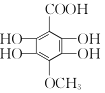 ;
;
(6)以![]() 为原料制备
为原料制备![]() ,
,![]() 可由苯乙烯和Br2发生加成反应得到,苯乙烯可由苯乙醇发生消去反应得到,苯乙醇可由苯乙酸甲酯发生还原反应得到,其合成路线为:
可由苯乙烯和Br2发生加成反应得到,苯乙烯可由苯乙醇发生消去反应得到,苯乙醇可由苯乙酸甲酯发生还原反应得到,其合成路线为: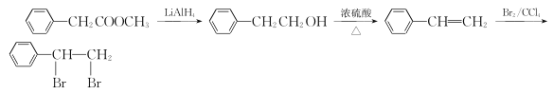


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】取一小块金属钠,用滤纸吸干表面的煤油,用小刀切开后,可看到断面呈____色,具有_____光泽,但断面很快变___________,主要是由于生成一薄层_______。若把钠放在石棉网上加热,可观察到的现象是_______________ ,反应的化学方程式为_______其中还原剂为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把18.4g由NaOH和NaHCO3组成的固体混合物在密闭容器中加热到约250摄氏度, 经充分反应后排出气体,冷却后称得固体质量为16.6g,试确定原混合物中NaOH与NaHCO3的物质的量的关系为( )
A.NaOH<NaHCO3B.NaOH>NaHCO3
C.NaOH=NaHCO3D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
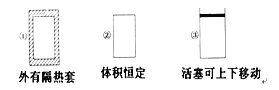
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法错误的是( )

A.通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极
B.0<V≤22.4 L时,电池总反应的化学方程式为CH4+2O2+2KOH=K2CO3+3H2O
C.22.4 L<V≤44.8 L时,负极电极反应为CH4-8e-+![]() +3H2O=
+3H2O=![]()
D.V=33.6 L时,溶液中只存在阴离子![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地煤矸石经预处理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及钙镁的化合物等。某实验小组利用其提取Al(OH)3
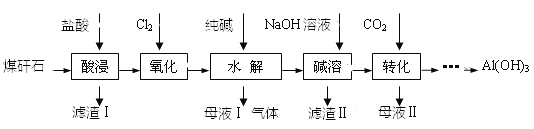
(1)“酸浸”过程中发生的主要反应的离子方程式为_______________。
(2)“氧化”的目的是_____________。检验Fe3+的方法是______________。
(3)滤渣I的主要成份________。溶于酸的反应方程式______________。
(4)②“转化”时主要反应的离子方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国矿石种类很多,如黄铜矿、煤、锰矿、锑锌矿等,请回答下列问题:
(l)黄铜矿的主要成分为二硫化亚铁铜(CuFeS2),基态Cu2+的外围电子排布图为 ______,Fe2+含有 ___个未成对电子。
(2)Mn的第三电离能比Fe的第三电离能大的原因为 ___。
(3)煤化工可得氨气、苯、甲苯等产品,氨的空间构型为 ___,甲苯分子上甲基的碳原子的杂化方式为____;氨硼烷化合物(NH3BH3)是一种新型化学氢化物储氢材料,氨硼烷的结构式为____(配位键用“→”表示),与氨硼烷互为等电子体的有机小分子为_____写名称)。
(4)碲化锌的晶胞结构如图1所示。
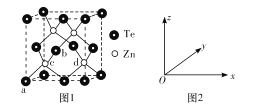
①碲化锌的化学式为____。
②图2可表示晶胞内部各原子的相对位置,已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() ),则d的原子坐标参数为____
),则d的原子坐标参数为____
③若两个距离最近的Te原子间距离为apm,阿伏加德罗常数值为NA,则晶体密度为____g/cm3(用含有NA、a的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如下图所示(不考虑C2O42-的水解)。下列叙述正确的是
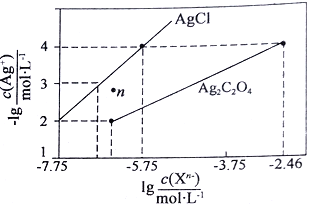
A.Ksp(Ag2C2O4)的数量级等于10-7
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4 沉淀
D.Ag2C2O4+2C1-=2AgCl+C2O42-的平衡常数为109.04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com