
已知单质铁溶于一定浓度的HNO3溶液中反应的离子方程式为:
aFe+bNO3﹣+cH+ ═ dFe2++fFe3++gNO↑+hN2O↑+kH2O,
化学计量数a~k均为正整数.则它们之间的关系错误的是
A.c=4g+10h B.a+c=d+f
C.2d+3f=3g+8h D.c﹣b=2d+3f
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述正确的是()
A.1mol Na被完全氧化生成Na2O2,失去NA个电子
B.1.0 L 0.1mol/L的NaAlO2溶液中含有的氧原子数为0.2NA
C.25℃pH=13的NaOH溶液中含有OH-的数目为0.1NA
D.1molCl2与足量的铁反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源:2015届四川省资阳市高三一诊理综化学试卷(解析版) 题型:填空题
(13分)有机物F是有机合成工业中一种重要的中间体。以甲苯和丙烯为起始原料合成F的工艺流程如下:
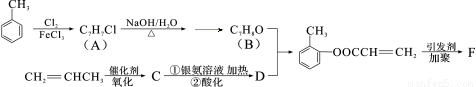
回答下列问题:
(1)化合物B中的含氧官能团名称是 。F的结构简式为 。
(2)写出C与银氨溶液共热的化学反应方程式: 。
(3)化合物D不能发生的反应有 (填序号)。
①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤水解反应
(4)B的含苯环结构的同分异构体还有 种,其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是 (填结构简式)。
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵阳市高三“一诊”模拟考试理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1mol[Ag (NH3)2]OH配合物中含有9NA个σ键
B.标准状况下,22.4L C2H6O中含C-H键5NA
C.1mol冰醋酸和lmol乙醇在加热和浓硫酸条件下充分反应生成的水分子数为NA
D.KClO3+6HCl ===KCl+3Cl2↑+3H2O反应中,生成71g Cl2时,转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵竹市高三上学期第二次月考化学试卷(解析版) 题型:填空题
(8分)现有A~G七种物质,已知A是赤铁矿的主要成分,E的浓溶液稀释时会放出大量的热,G溶液为蓝色,它们之间存在如图所示的转化关系:
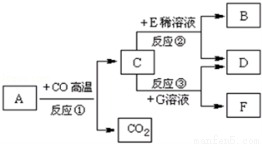
(1)写出下列物质的化学式:
E: D: F:
(2)在反应①②③中,属于置换反应的是 (填序号).
(3)工业上常利用反应①的原理来炼铁,写出反应①的化学方程式 .
(4)写出物质C与E的稀溶液发生反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵竹市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列关于摩尔的叙述,正确的是
A.摩尔是代表微观粒子多少的物理量
B.摩尔是物质的量的单位
C.摩尔是粒子数与阿伏伽德罗常数之比
D.摩尔是描述宏观物质多少的单位
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三(补习班)10月月考理综化学试卷(解析版) 题型:实验题
(17分)绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
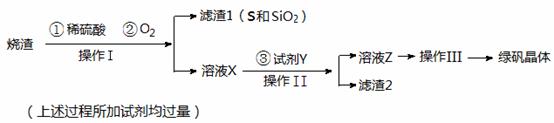
试回答:
(1)操作I为 (填写操作名称)。
(2)操作III的顺序依次为: 、冷却结晶、过滤 、 、干燥。
(3)试剂Y(一种单质)与溶液X反应的离子方程式为 。
(4)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需
②该同学设计的下列滴定方式,最合理的是 (夹持部分略去)(填字母序号)
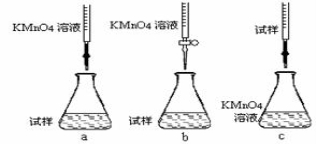
③滴定时发生反应的离子方程为:
④若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果 (填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g) ΔH>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见下表,下列说法中不正确的是
4NO2(g)+O2(g) ΔH>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见下表,下列说法中不正确的是
t/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
A.500 s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数K1=125
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再次平衡时c(N2O5)>5.00 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高三第三次月考化学试卷(解析版) 题型:选择题
能在水溶液中大量共存的一组离子是
A.H+、I―、NO3―、SiO32-
B.Ag+、Fe3+、Cl―、SO42―
C.K+、SO42-、Cu2+、NO3―
D.NH4+、OH-、Cl-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com